
| A. | 氯化钠与浓硫酸混合加热后,撒入二氧化锰即放出氯气 | |
| B. | 过氧化氢中加入几滴氯化铁溶液,可较快放出气体 | |
| C. | 在木炭粉中加入微量氯酸钾,燃烧时极为剧烈 | |
| D. | 用锌与稀硫酸反应制备氢气时,加入少量硫酸铜加快反应 |
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:解答题
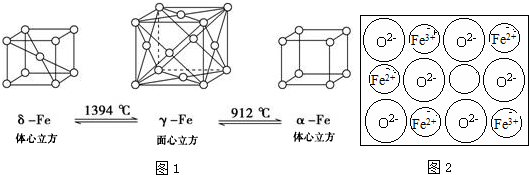
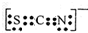 .Fe3+与SCN-可以形成配位数1~6的配离子,若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl.
.Fe3+与SCN-可以形成配位数1~6的配离子,若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中水电离出的H+个数:②>① | |
| B. | ①溶液中阴离子的总浓度小于0.01 mol•L-1 | |
| C. | ②溶液中:n(OH-)=n(HCO3-)+2n(H2CO3)+n(H+) | |
| D. | ②溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有非极性共价键的化合物分子一定是非极性分子 | |
| B. | 原子晶体中只存在非极性共价键 | |
| C. | 冰主要是水分子通过氢键作用而形成的分子晶体 | |
| D. | 若元素R的含氧酸的酸性大于元素Q的含氧酸的酸性,则非金属性R大于Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、CCl4、CH4三个分子中所有原子都满足最外层8电子结构 | |
| B. | 第ⅠA族的金属元素形成的单质的熔点随原子序数的递增而降低 | |
| C. | 第ⅦA族元素形成的单质的熔点随原子序数的递增而降低 | |
| D. | 第ⅠA族元素燃烧形成的氧化物中氧的化合价都不是-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;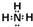 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用25 mL酸式滴定管量取20.00 mL KMnO4溶液 | |
| B. | 图1可表示0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1CH3COOH溶液所得到的滴定曲线 | |
| C. | 做导电实验时,强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 | |
| D. | 其它条件相同下,图2可探究Fe3+和Cu2+对H2O2分解反应的催化效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
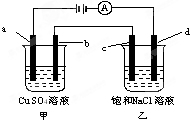
| A. | 甲烧杯中溶液的pH增大,乙烧杯中溶液的pH减小 | |
| B. | 甲烧杯中a电极发生氧化反应,电极反应式为:4OH--4e-═O2↑+2H2O | |
| C. | 电解一段时间后,b极质量增加,c极附近滴加酚酞溶液变红 | |
| D. | C是阳极,电子从d电极通过溶液流向c电极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com