
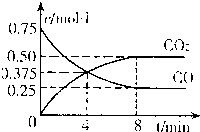 铁元素及其化合物与人类的生产生活息息相关,
铁元素及其化合物与人类的生产生活息息相关, O2(g)═FeO(s)△H=-272kJ?mol-1
O2(g)═FeO(s)△H=-272kJ?mol-1 O2(g)═FeO(s)△H=-272kJ?mol-1
O2(g)═FeO(s)△H=-272kJ?mol-1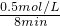 =0.625mol?L-1?min-1;
=0.625mol?L-1?min-1; =
= =2;
=2;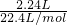 =0.1mol,
=0.1mol, ×(0.16L×5mol/L-0.2mol)=0.2mol,
×(0.16L×5mol/L-0.2mol)=0.2mol,

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源:潍坊一模 题型:问答题
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
铁元素及其化合物与人类的生产生活息息相关,
试回答下列问题:
(1)电子工业常用30%,的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,写出该反应的离子方程式 。
(2)高炉炼铁过程中会发生反应:FeO(s)+CO(g) ![]() Fe(s)+CO2(g)。
Fe(s)+CO2(g)。
已知:Fe(s)+![]() O2(g)=FeO(s)△H=-272kJ·mol-1
O2(g)=FeO(s)△H=-272kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-22lkJ·mol-1
则:①FeO(s)+CO(g) ![]() Fe(s)+CO2(g) △H= 。
Fe(s)+CO2(g) △H= 。

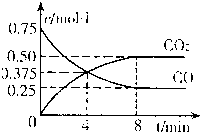
②一定温度下,向某密闭容器中加人足量FeO,并充人一定量的CO气体,反应过程中CO和CO2的浓度与时间的关系如图所示
则从开始至达到平衡过程中,![]() (CO)= ;该温 度下,
(CO)= ;该温 度下,
FeO(s)+CO(g)![]() Fe(s)+CO2(g)
Fe(s)+CO2(g)
的化学平衡常数K= 。
(3)铁红是一种红色颜料,其成份是Fe2O3。将一定量的铁红溶于160mL5mol·L-1盐酸中,再加人一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为 。
查看答案和解析>>
科目:高中化学 来源:2010年山东省潍坊市高考化学一模试卷(解析版) 题型:解答题
 O2(g)═FeO(s)△H=-272kJ?mol-1
O2(g)═FeO(s)△H=-272kJ?mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com