
【题目】在下列各溶液中,离子一定能大量共存的是( )
A.强碱性溶液中:K+、Al3+、Cl-、SO![]()
B.室温下,pH=1的盐酸中:Na+、Fe2+、NO![]() 、SO
、SO![]()
C.含有Ca2+的溶液中:Na+、K+、CO![]() 、Cl-
、Cl-
D.水电离产生的c(H+)=1x10-13 mol/L的溶液中:Na+、K+、Cl-、SO![]()
 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.溶液与胶体:本质区别是能否发生丁达尔效应
C.常温下可以用铝或铁制容器贮存浓硝酸和浓硫酸
D.用焰色反应鉴别NaCl溶液和![]() 溶液
溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

⑴充电时阳极反应为___。
⑵放电时负极反应为___。
⑶放电过程中OH-通过隔膜从区移向___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池总反应为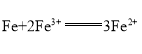 ,下列与此电池总反应不符的原电池是( )
,下列与此电池总反应不符的原电池是( )
A.铜片、铁片、![]() 溶液组成的原电池
溶液组成的原电池
B.石墨、铁片、![]() 溶液组成的原电池
溶液组成的原电池
C.铁片、锌片、![]() 溶液组成的原电池
溶液组成的原电池
D.银片、铁片、![]() 溶液组成的原电池
溶液组成的原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把活泼金属片a和b放在盛有稀食盐水和酚酞混合液的表面皿中,构成如图所示原电池,一段时间后观察到区域I变红色,则下列叙述正确的是( )
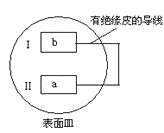
A.a是原电池的负极B.b的活泼性大于a
C.无电流产生D.b 电极上有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,下列实验用如图所示装置不能完成的是

A. 确定分子式为C2H6O的有机物的结构
B. 测定Na2O和Na2O2混合物中Na2O2的含量
C. 测定Na2SO4x H2O晶体中结晶水数目
D. 比较Fe3+和Cu2+对双氧水分解反应的催化效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是( )
A.将 HCl 与 CH3COONa 两溶液混合后,溶液呈中性,则 c(Na+) < c(Cl-)
B.向 NH4Cl 溶液中通 NH3,则 c(![]() ) >c(Cl-) > c(OH-)> c(H+)
) >c(Cl-) > c(OH-)> c(H+)
C.室温下,c(![]() )相同的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2 溶液浓度大小顺序为:①>②>③
)相同的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2 溶液浓度大小顺序为:①>②>③
D.已知 pKa= -lgKa,pKa(HF)=3.1,pKa(C6H5COOH) = 4.2,室温下,等体积、等浓度的 NaF、C6H5COONa 溶液中,前者离子总数小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋![]() 华阳国志
华阳国志![]() 南中志
南中志![]() 卷四中已有关于白铜的记载,云南镍白铜
卷四中已有关于白铜的记载,云南镍白铜![]() 铜镍合金
铜镍合金![]() 闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)已知:丁二酮肟[HON=(CH3)CC(CH3)=NOH]是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为___,1mol丁二酮肟分子所含σ键的数目为___。
(2)单质铜及镍都是金属晶体;铜晶体的堆积方式为___;元素铜与镍的第二电离能分别为:ICu=1958kJ·mol-1、INi=1753kJ·mol-1,ICu>INi的原因是___。
(3)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构见图(1)。写出该反应的化学方程式:___。

(4)下列关于铁和镍及其化合物说法正确的是___
a.金属镍能与CO形成配合物Ni(CO)4,常温下为液态,易溶于CCl4、苯等有机溶剂。所以Ni(CO)4固态时属于分子晶体
b.[Ni(NH3)6]SO4中阴离子的立体构型是正八面体
c.Ni2+和Fe2+的半径分别为69pm和78pm,则晶格能NiO>FeO,熔点NiO>FeO
d.铁晶胞结构见图(2),每个晶胞含有2个铁原子
(5)配合物Y的结构见图(3),Y中含有的化学键有___![]() 填序号
填序号![]() ;
;
a.极性共价键 b.非极性共价键 c.配位键 d.氢键 e.离子键 f.金属键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(固)+nB(气)![]() pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
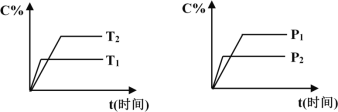
A. 达到平衡后,使用催化剂,C%将增大
B. 达到平衡后,若升高温度、化学平衡向逆反应方向移动
C. 方程式中n>p+q
D. 达到平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com