
| A. | 移液后未洗涤烧杯 | |
| B. | 在容量瓶中进行定容时,仰视刻度线 | |
| C. | 在容量瓶中进行定容时,俯视刻度线 | |
| D. | 定容后摇匀,发现液面低于刻度线,再加水至刻度线 |
分析 分析操作对溶质的物质的量n及溶液体积V的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:A.移液后未洗涤烧杯,导致溶质的物质的量偏小,溶液的浓度偏低,故A不选;
B.在容量瓶中进行定容时,仰视刻度线,导致溶液的体积偏大,溶液浓度偏低,故B不选;
C.在容量瓶中进行定容时,俯视刻度线,导致溶液的体积偏小,溶液浓度偏高,故C选;
D.定容后摇匀,发现液面低于刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故D不选;
故选:C.
点评 本题考查了一定物质的量浓度溶液配制误差分析,明确配制原理,熟悉用C=$\frac{n}{V}$判断的技巧是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用土填埋废弃塑料,防止白色污染 | |
| B. | 使用车乙醇汽油,防止温室效应 | |
| C. | 化工厂加高烟囱排放废气,防止酸雨 | |
| D. | 废旧电池中汞的回收可减少对环境的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该混合液中一定含有:K+、NH4+、CO32-、SO42-,可能含Cl- | |
| B. | 该混合液中-定含有:NH4+、CO32-、SO42-,可能含K+、Cl- | |
| C. | 该混合液中一定含有:NH4+、CO32-、SO42-、Cl-,可能含K+ | |
| D. | 该混合液中:c(K+)≥0.1mol/L c(CO32-)=0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
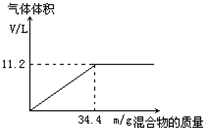 在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应.如图表示加入的混合物的质量与产生的气体体积(标准状况)的关系.
在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应.如图表示加入的混合物的质量与产生的气体体积(标准状况)的关系.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相关信息 | |
| X | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得X的单质 |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
 ;
; ,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.
,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①②⑤⑥⑦ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤⑥ | B. | ②③④⑤⑥ | C. | ④⑤ | D. | ③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com