
| A. | 用pH试纸测试 | B. | 用闻气味和pH试纸测试 | ||
| C. | 用Ba(OH)2溶液和酚酞试液 | D. | 用NaOH和BaCl2溶液鉴别 |
分析 KCl为中性、NH3•H2O为碱性、(NH4)2SO4、H2SO4均显酸性,但硫酸的酸性强,测定pH为鉴别的最佳方案,以此来解答.
解答 解:A.用pH试纸测试,pH最大的为NH3•H2O,其次为KCl,最小的为H2SO4,可鉴别,且方法最佳,故A选;
B.只有NH3•H2O有刺激性气味,再测定pH可鉴别,方法不最佳,故B不选;
C.用Ba(OH)2溶液可分成两组,(NH4)2SO4、H2SO4均生成白色沉淀,且酚酞不能鉴别二者,故C不选;
D.NaOH、BaCl2不能鉴别KCl、NH3•H2O,故D不选;
故选A.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与应用能力的考查,注意最佳鉴别方案的选择,题目难度不大.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 使用时电池负极区溶液的碱性增强 | |
| B. | 使用时电子由Ag2O极经外电路流向Zn极 | |
| C. | 溶液中OH-离子由正极向负极移动 | |
| D. | Zn电极发生还原反应,Ag2O电极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2O所含电子数为10NA | |
| B. | 1 mol Al与足量的稀盐酸溶液反应生成氢气1.5 mol | |
| C. | 在标准状况下,0.5NA Cl2所占的体积约是11.2 L | |
| D. | 在非标准状况下,22.4 L O2含有的分子数一定不是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
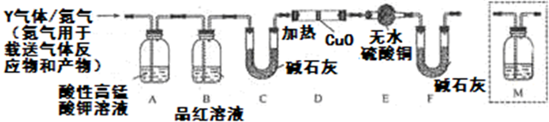
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核内有10个中子的氧原子818O | B. | 乙烯的结构简式为:C2H4 | ||
| C. | CH4分子的比例模型: | D. | -CH3(甲基)的电子式为: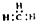 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热前消耗的多 | |
| B. | 加热后消耗的多 | |
| C. | 加热前后均消耗0.02amolHCl | |
| D. | 当n(NaOH)>n(NaHCO3)时消耗的才会一样多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com