
已知Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12。在只含有KCl、K2CrO4的混合溶液中滴加0.001 mol·L-1的AgNO3溶液,当AgCl与Ag2CrO4共存时,测得溶液中CrO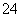 的浓度是5.000×10-3 mol·L-1,此时溶液中Cl-的物质的量浓度是( )
的浓度是5.000×10-3 mol·L-1,此时溶液中Cl-的物质的量浓度是( )
A.1.36×10-5 mol·L-1 B.8.90×10-6 mol·L-1
C.4.45×10-2 mol·L-1 D.1×10-5 mol·L-1
科目:高中化学 来源: 题型:
下列五种烃:①异戊烷 ②新戊烷 ③丙烷 ④正戊烷 ⑤异丁烷,其沸点按由高到低的顺序排列正确的是( )
A.①②③④⑤ B.②③④⑤①
C.⑤ ② ① ③ ④ D.④ ① ② ⑤ ③
查看答案和解析>>
科目:高中化学 来源: 题型:
金属冶炼与处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是________。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应:2Cu2S+2H2SO4+5O2===4CuSO4+2H2O,该反应的还原剂是________。当1 mol O2发生反应时,还原剂所失电子的物质的量为________ mol。向CuSO4溶液中加入镁条时有气体生成,该气体是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是( )
A.某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7,则该溶液的pH一定为14-a
B.某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度的大小关系一定是:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-)+c(HR-)=c(Na+)
D.将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH-)=2c(H+)+c(HA)-c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知一定温度下,有下列难溶电解质的相关数据:
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25 ℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不正确的是( )
A.向该混合溶液中加过量铁粉,能观察到红色固体析出
B.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
C.该混合溶液中c(SO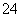 ):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4
):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4
D.向该混合溶液中加入适量氯水,并调pH至3~4后过滤,能得到纯净的CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
锌烂板液是制作印刷锌板时用稀HNO3腐蚀锌板后得到的废液,主要含Zn(NO3)2和自来水带进的Cl-、Fe3+等杂质离子。某兴趣小组在实验室中由锌烂板液制取ZnSO4·7H2O的步骤如下:
①在锌烂板液中逐渐加入6 mol/L氢氧化钠溶液,用pH试纸检验,直至pH=8;
②过滤后得到粗Zn(OH)2沉淀,用蒸馏水多次洗涤沉淀;
③用2 mol/L硫酸慢慢将洗净的粗Zn(OH)2沉淀溶解,保持一定pH,加热煮沸,趁热过滤,滤液即为ZnSO4溶液;
④在滤液中注入2 mol/L的硫酸,调节pH为2左右,后经相关操作得到ZnSO4·7H2O晶体。
已知:常温下,Fe3+在pH=1.9开始沉淀,pH=3.2沉淀完全;Zn2+在pH=6.4开始沉淀,pH=8.0沉淀完全;Zn(OH)2的化学性质与Al(OH)3相似。
(1)在以上所有步骤中都需要用到的仪器是烧杯、___________。
(2)步骤②的目的是除去________________等杂质离子,检验沉淀是否已洗净的具体操作是________________。
(3)步骤①保持pH=8的目的是________________,步骤④保持pH =2的目的是________________。
(4)步骤③为了除去Fe3+,故保持的pH范围为_____________,加热煮沸的目的是________________。
(5)步骤④中得到ZnSO4·7H2O晶体的操作步骤为____________、________________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的描述正确的是
A.用湿润的pH试纸测定溶液的pH,测定结果偏小,该溶液一定呈酸性
B.中和滴定实验中,锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,须干燥 或用待装液润洗后方可使用
C.将碘水倒入分液漏斗,加入适量乙醇,振荡后静置,能将碘萃取到乙醇中
D.向含有FeCl2杂质的FeCl3溶液中通入足量C12后,充分加热蒸干,可得到纯净的FeCl3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
向含有1mol的FeCl2溶液中通入0.2molCl2,再加入含0.1mol X2O72- 的酸性溶
液,使溶液中Fe2+全部恰好氧化,并使 X2O72- 还原为Xn+,则n值为
 A.2 B.3 C.4 D.5
A.2 B.3 C.4 D.5
查看答案和解析>>
科目:高中化学 来源: 题型:
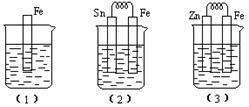
如下图所示,烧杯中都盛有稀硫酸:
① 装置(2)中Fe电极的电极反应:
,
装置(3)中Fe电极的电极反应:
;
② 装置(2)Sn极附近溶液的pH ;(填:“增大”、“减小”或“不变”)
③ 比较(1)、(2)、(3)中铁被腐蚀的速率由快到慢的顺序是 。(填“序号”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com