
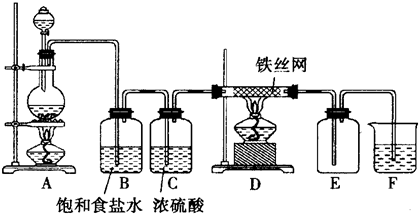
分析 (1)实验室用二氧化锰与浓盐酸反应制备氯气;
(2)饱和食盐水的作用是除去氯气中的氯化氢气体;
(3)铁在氯气中燃烧生成氯化铁;
(4)用氢氧化钠吸收尾气.
解答 解:(1)A.二氧化锰与浓盐酸反应生成氯化锰、水、氯气,方程式为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,所以离子反应方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)饱和食盐水的作用是除去氯气中的氯化氢气体,故答案为:除去氯气中的氯化氢气体;
(3)铁在氯气中燃烧生成氯化铁,化学反应方程式为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,故答案为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
(4)用氢氧化钠吸收尾气,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O.
点评 本题考查了氯气的制备和性质的检验,题目综合性较强,难度中等,


科目:高中化学 来源: 题型:选择题
| A. | 双氧水、高锰酸钾溶液可以完全灭活埃博拉病毒,其消毒原理与漂白粉消毒饮用水的原理相同 | |
| B. | 不法商家制取的“地沟油”具有固定的熔沸点 | |
| C. | 食品保鲜膜按材质可分为聚乙烯(PE)、聚氯乙烯(PVC)等,PVC的单体可由PE的单体与氯化氢加成制得 | |
| D. | 乙醇用作医用消毒剂时,无水乙醇消毒效果最好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第4周期ⅢA族 | B. | 第4周期ⅦA族 | C. | 第3周期Ⅳ族 | D. | 第3周期ⅣA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z、W的原子半径的大小关系为:W>Y>Z>X | |
| B. | 在化合物Y2X2、Z2X4、X2W2中,分子所含的共用电子对数相等 | |
| C. | 与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键 | |
| D. | X、Y、Z、W四种元素可形成化学式为Y2X5ZW2的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
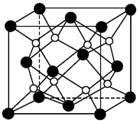 (1)原子序数小于36的X、Y、Z、W四种元素,其中X是元素周期表中原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.回答下列问题:
(1)原子序数小于36的X、Y、Z、W四种元素,其中X是元素周期表中原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气是一种黄绿色、有刺激性气味的气体 | |
| B. | 氯气、液氯和氯水是同一种物质 | |
| C. | 氯气能溶于水 | |
| D. | 氯气是一种有毒的气体,可用NaOH溶液吸收 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com