
| 共价键 | 键能 |
| H-H | 436 |
| H-F | 565 |
| H-S | 339 |
| H-Se | 314 |
| A. | H2(g)→2H (g)-436kJ | B. | H(g)+F(g)→HF (g)+565kJ | ||
| C. | HF的热稳定性大于H2S | D. | H2S的沸点比H2Se的沸点高 |
分析 A.氢气变化为氢原子吸热等于氢气中断裂化学键需要的能量;
B.H(g)与F(g)结合放出热量;
C.键能越大越稳定;
D.H2Se和H2S结构相似,分子间只存在范德华力.
解答 解:A.氢气变化为氢原子吸热等于氢气中断裂化学键需要的能量,H2(g)→2H (g)-436kJ,故A正确;
B.H(g)与F(g)结合放出热量,H(g)+F(g)→HF (g)+565kJ,故B正确;
C.HF的键能大于H2S,键能越大越稳定,故C正确;
D.H2Se和H2S结构相似,分子间只存在范德华力,相对分子质量越大,沸点越高,故正确顺序为H2Se>H2S,故D错误.
故选D.
点评 本题考查化学键与能量的关系等知识,侧重于学生的分析能力的考查,为高频考点,掌握键能与能量变化的关系是解题的关键,难度中等.


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
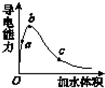 在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况如图所示,回答下列问题.
在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况如图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢离子浓度相同 | |
| B. | 导电能力相同 | |
| C. | 相同体积时,中和NaOH的能力相同 | |
| D. | 加水稀释10倍后,溶液的pH值均上升1个单位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 冷的氢氧化钠溶液中通入氯气:Cl2+2OH-═ClO-+Cl-+H2O | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-═2 BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L | B. | 0.5L | C. | 0.3L | D. | 0.6L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示装置为在直流电的作用下电解200molNaCl溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源,通电一段时间后,B电极产生能使湿润的淀粉碘化钾试纸变蓝的气体224mL(标准状况),则:
如图所示装置为在直流电的作用下电解200molNaCl溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源,通电一段时间后,B电极产生能使湿润的淀粉碘化钾试纸变蓝的气体224mL(标准状况),则:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 教材中有一个演示实验:用脱脂棉包住约0.2g Na2O2粉末,置于石棉网上,可观察到脱脂棉燃烧起来.
教材中有一个演示实验:用脱脂棉包住约0.2g Na2O2粉末,置于石棉网上,可观察到脱脂棉燃烧起来.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com