
| A、H+ Na+ NO3- SO42- |
| B、Na+ CO32- Cu2+ Cl- |
| C、K+ Na+ Cl- SO42- |
| D、K+ Cl- Ba2+ HCO3- |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙、丙为三种单质,A、B、C 是三种常见化合物,A为淡黄色固体.它们之间的
甲、乙、丙为三种单质,A、B、C 是三种常见化合物,A为淡黄色固体.它们之间的查看答案和解析>>
科目:高中化学 来源: 题型:
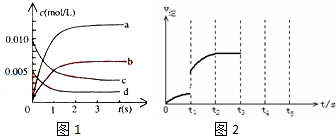
| 时间(S) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Na2O2是常见的氧化剂.某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物.
Na2O2是常见的氧化剂.某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、① | C、② | D、都不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与等体积、pH=3的盐酸比较,跟足量锌粒反应产生的H2更多 |
| B、加水稀释到原体积的10倍后溶液pH变为4 |
| C、加入少量乙酸钠固体,溶液pH升高 |
| D、溶液中粒子浓度大小关系为:c(H+)>c(CH3COOH)>c(CH3COO-)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com