
分析 (1)硫酸是二元强酸、盐酸是一元强酸、醋酸是一元弱酸,同体积同物质的量浓度的三种酸,中和NaOH能力与氢的物质的量成之比,氢的物质的量越大,需要的氢氧化钠的物质的量越大;
(2)c(H+)相同、体积相同时,生成氢气体积大小与最终氢离子的物质的量成正比;
(3)加水稀释促进醋酸电离.
解答 解:(1)同体积同物质的量浓度的三种酸,三种酸n(HCl)=n(CH3COOH)=n(H2SO4),盐酸和醋酸是一元酸,硫酸是二元酸,盐酸和醋酸需要氢氧化钠的物质的量相等,硫酸需要的氢氧化钠是盐酸和醋酸的2倍,中和NaOH能力由大到小的顺序是b>a=c,故答案为:b>a=c;
(2)当c(H+)相同、体积相同时,醋酸的浓度最大,反应过程中生成的氢离子最多,盐酸和硫酸中氢离子的物质的量相等,所以分别加入足量锌,生成氢气体积为c>a=b,故答案为:c>a=b;
(3)加水稀释促进醋酸电离,盐酸和硫酸完全电离,溶液中氢离子浓度相等,所以稀释后溶液中氢离子浓度大小顺序是a=b<c,故答案为:c>a=b.
点评 本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,知道反应过程、稀释构成中醋酸都不断电离出氢离子,为易错点.


 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 一滴香: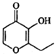 | B. | 芬必得: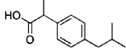 | ||
| C. | 维生素B5: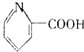 | D. | 扑热息痛: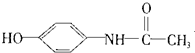 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH增加 | B. | CH3COOH电离程度增大 | ||
| C. | 导电能力减弱 | D. | c(OH-) 减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解时电解池的阳极一定是阴离子放电 | |
| B. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行:则该反应的△H>0 | |
| C. | 其他条件不变,增大压强,平衡可能移动,但平衡常数一定不变 | |
| D. | 铁制品表面镶锌块和铁制品表面镀锡,都能起到防腐的作用且防腐原理是相同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3 | B. | FeCl2 | C. | Fe(OH)3 | D. | Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com