
有四种物质:①NaHCO3、②Al(OH)3、③(NH4)2S、④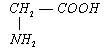
,其中既能跟盐酸,又能跟NaOH溶液反应的有( )
| A.只有②④ | B.只有①② | C.只有①②③ | D.①②③④ |
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
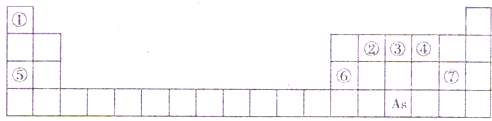
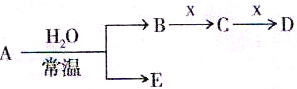
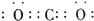
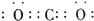
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
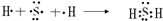
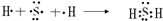

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2011?丹东模拟)有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
(2011?丹东模拟)有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com