
| A. | -1 | B. | 0 | C. | +1 | D. | +2 |
科目:高中化学 来源: 题型:选择题
| A. | 苯、乙烯都既能发生加成反应,也能发生氧化反应 | |
| B. | 塑料、橡胶和合成纤维都属于有机高分子化合物 | |
| C. | 糖类、脂肪和蛋白质在一定条件下都能发生水解反应 | |
| D. | 分子式为C5H12的有机物有三种,它们属于同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
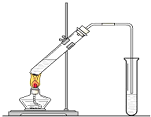 如图,在一支试管中先加入3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸;按图连接好装置,用酒精灯缓慢加热,观察现象.
如图,在一支试管中先加入3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸;按图连接好装置,用酒精灯缓慢加热,观察现象. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | 只有①③ | C. | 只有②③ | D. | 只有① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4、C2H6、C3H8 | B. | C2H4、C2H6、CH4 | C. | CH4、C2H2、C2H6 | D. | C2H6、C3H6、C4H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学平衡常数的大小与温度、浓度、压强、催化剂有关 | |
| B. | CH3COONH4溶液几乎呈中性,说明Ka(CH3COOH)与 Kb(NH3•H2O)近似相等 | |
| C. | Ksp(AgCl)>Ksp(AgI)由此可以判断AgCl(s)+I-═AgI(s)+Cl-不能够发生 | |
| D. | Ka(HCN)<Ka(CH3COOH)说明相同浓度时,氢氰酸的酸性比醋酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 有关信息 |
| X | 在元素周期表中原子半径最小 |
| Y | 最外层电子数是次外层的2倍 |
| Z | 元素的主要合价为一2价 |
| M | 其单质及化合物的焰色反应呈黄色 |
| N | 与Y同主族,其单质为半导体 |
 ;M2Z中所含化学键类型是离子键.
;M2Z中所含化学键类型是离子键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
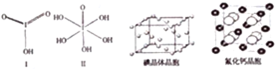
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com