
| A. | 反应2Mg+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+C△H<0从熵变角度看,可以自发进行 | |
| B. | 在密闭容器发生可逆反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-113.0kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,△H变小 | |
| C. | 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生 | |
| D. | 根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者 |
分析 A.判断反应自发进行需要根据焓变和熵变两个因素,缺一不可;
B.反应是气体体积减小的反应,缩小体积,增大压强,平衡正向进行放出的热量增大,焓变是和反应物生成物能量有关,与变化过程无关;
C.依据溶度积规则,计算生成AgCl、Ag2CrO4沉淀时银离子的浓度,据此判断;
D.依据电离平衡常数可知碳酸酸性大于次氯酸大于碳酸氢根离子,对应盐水解程度碳酸氢钠水解程度小于次氯酸钠小于碳酸钠.
解答 解:A.判断反应自发进行需要根据焓变和熵变两个因素,缺一不可,所以只看熵变不能确定反应能否自发进行,故A错误;
B.反应是气体体积减小的反应,缩小体积,增大压强,平衡正向进行放出的热量增大,焓变是和反应物生成物能量有关,与变化过程无关,△H不变,故B错误;
C.AgCl饱和所需Ag+浓度c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=1.8×10-6mol/L;Ag2CrO4饱和所需Ag+浓度c(Ag+)=$\sqrt{\frac{Ksp}{c(Cr{{O}_{4}}^{2-})}}$=$\sqrt{\frac{2×1{0}^{-12}}{1×1{0}^{-4}}}$=1.4×10-4mol/L,则1.8×10-6mol/L<1.4×10-4mol/L),所以Cl-先沉淀.故C错误;
D.电离平衡常数可知碳酸酸性大于次氯酸大于碳酸氢根离子,对应盐水解程度碳酸氢钠水解程度小于次氯酸钠小于碳酸钠,相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者,故D正确;
故选:D.
点评 本题考查了反应自发进行的判断依据,化学平衡移动方向分析判断,沉淀溶解平衡的计算应用,弱电解质的电离和盐类水解的分析应用,题目综合性较强,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥ | B. | ②④⑥ | C. | ②⑥ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠可用于呼吸面具中作为氧气来源 | |
| B. | 明矾溶于水最终可形成的Al(OH)3胶体,能吸附水中悬浮物以净化水 | |
| C. | 可用Na2CO3 治疗胃酸过多 | |
| D. | 铝制餐具不宜长期存放酸性、碱性或咸的食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,关于该有机物下列叙述不正确的是( )
,关于该有机物下列叙述不正确的是( )| A. | 能使溴水褪色 | |
| B. | 一定条件下,能和NaOH醇溶液反应 | |
| C. | 在加热和催化剂作用下,最多能和4 mol H2发生加成反应 | |
| D. | 能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L水中含有1 mol硫酸 | |
| B. | 1 L溶液中含1 mol H+ | |
| C. | 将98 g硫酸溶于1 L水所配成的溶液 | |
| D. | 从1 L溶液中取出500 mL后,剩余溶液的浓度仍为1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、CO、O2、CaO | B. | O2、CO、CO2、CaCO3 | C. | O2、CO2、CO、CaCO3 | D. | CO、CO2、O2、Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
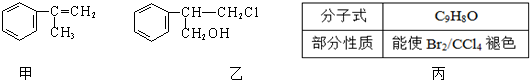
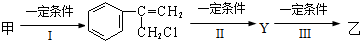
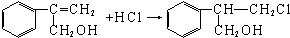 (不需注明反应条件).
(不需注明反应条件).
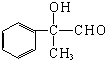 ;丙的结构简式为
;丙的结构简式为 .
. 、
、 、
、 其中一种.
其中一种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com