
【题目】镁、铝、铁、铜四种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有
A.Cu2+
B.AlO2-
C.Al3+
D.Mg2+
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】若在加入铝粉能放出H![]() 的溶液中,下列各组离子一定不能大量共存的是
的溶液中,下列各组离子一定不能大量共存的是
A. Na![]() 、Fe
、Fe![]() 、SO
、SO![]() 、Cl
、Cl![]()
B. Ba![]() 、Mg
、Mg![]() 、HCO
、HCO![]() 、NO
、NO![]()
C. Na![]() 、K
、K![]() 、NO
、NO![]() 、CO
、CO![]()
D. K![]() 、NO
、NO![]() 、AlO
、AlO![]() 、OH
、OH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中有NH4+、Na+、Fe2+和K+四种阳离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量的盐酸,溶液中物质的量几乎不变的阳离子是
A.NH4+
B.Na+
C.Fe2+
D.K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为________;砷酸的第一步电离方程式为_____________。
(2)“一级沉砷”中FeSO4的作用是___________;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_____________。
(3)沉淀X为___________(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的 最低检出限为3.0×10-6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
(4)AsH3的电子式为_______________。
(5)步骤2的离子方程式为_________________。
(6)固体废弃物的排放标准中,砷元素不得高于4.0×10-5g·kg-1,请通过计算说明该排放的废渣中砷元素的含量_______(填“符合”、“不符合”)排放标准,原因是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式表达正确的是
A. 硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++ H2O2 +2H+= 2Fe3++2H2O
B. 用食醋除水垢:CaCO3+2H+=Ca2++CO2↑+H2O
C. 向NaClO溶液中通入少量SO2: 2C1O-+SO2+H2O=SO32-+2HClO
D. Na2S溶于水呈碱性:S2-+ 2H2O![]() H2S +2OH-
H2S +2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
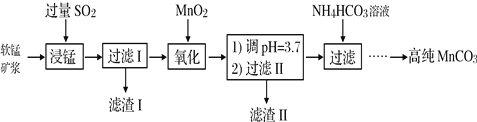
(1)浸锰过程中Fe2O3与SO2反应的化学方程式为Fe2O3+ SO2+2H+=2Fe2++ SO42-+ H2O,该反应是经历以下两步反应实现的。写出ⅱ的离子方程式:_____________。
ⅰ:Fe2O3 + 6H+ = 2Fe3++3H2O
ⅱ:……
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_____________(填离子符号)。
(3)写出氧化过程中MnO2与SO2反应的化学方程式:_________________。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是___________________。

(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:___________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的产量是衡量一个国家石油工业发展水平的标志,可发生以下系列转化, B、D是生活中常见的两种有机物,下列说法不正确的是

A.A的结构简式为CH2=CH2
B.1molB物质可以与足量Na反应生成0.5molH2
C.B、D、E三种物质可以用饱和Na2CO3溶液鉴别
D.由B、D制备E浓H2SO4只作吸水剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com