
分析 (1)同周期从左到右非金属性逐渐增强;
(2)根据原子的最外层电子数判断;
(3)利用质量守恒定律判断A的化学式,再根据微粒之间的作用力分析;电子层结构相同的离子,原子序数越大,半径越小;不同非金属元素之间形成极性键,分子结构对称,正负电荷中心重叠的分子为非极性分子;
(4)CN-与N2结构相似,氮气的结构为N≡N,据此分析.
解答 解:(1)已知化学方程式是:2KNO3+3C+S→A+N2↑+3CO2↑,根据同周期从左到右非金属性逐渐增强,所以非金属性由强到弱的顺序依次为:O、N、C;
故答案为:O、N、C;
(2)O、S的最外层含有6个电子,其中有4个为成对电子,2个为未成对电子;
故答案为:O、S;
(3)由化学方程式为S+2KNO3+3C→A+N2↑+3CO2↑,根据质量守恒定律可知,反应前后元素种类、原子个数相等,则A的化学式为K2S;K2S中K+与S2-之间以离子键结合,所以其晶体类型为离子晶体;K+与S2-的电子层结构相同,原子序数越大,半径越小,则S2->K+;不同非金属元素之间形成极性键,分子结构对称,正负电荷中心重叠的分子为非极性分子,生成物中CO2是含极性共价键的非极性分子;
故答案为:K2S;离子晶体;S2->K+;CO2;
(4)CN-与N2结构相似,氮气的结构为N≡N,C原子形成4个共价键,所以HCN的结构式为H-C≡N;
故答案为:H-C≡N.
点评 本题考查了非金属性的比较、质量守恒的应用、晶体类型的判断、半径比较等,题目涉及的知识点较多,侧重于基础知识的考查,难度不大.


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:选择题
| A. | Li、Be、B原子最外层电子数依次减少 | |
| B. | P、S、Cl元素最高正价依次降低 | |
| C. | Na、K、Rb的金属性依次增强 | |
| D. | N、O、F原子半径依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不再改变 | |
| B. | 混合气体的颜色不再改变 | |
| C. | 混合气体的压强不再改变 | |
| D. | I2、H2在混合气体中的体积分数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 12 g14C中含有的中子数是8NA | |
| B. | 28g氮气含有的原子数是2NA | |
| C. | 1mol铁与足量稀硝酸完全反应,失去的电子数3NA | |
| D. | 标准状况下,4.48 L NO和2.24 L O2混合气体中含分子总数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16、30、58、72 | B. | 16、28、40、52 | C. | 16、32、48、54 | D. | 16、30、42、56 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

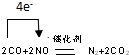 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱碱的浓度大于强酸的浓度 | |
| B. | 反应后的溶液呈酸性 | |
| C. | 原氨水中有1%的含氮微粒为NH4+ | |
| D. | 反应后的溶液中NH4+、NH3•H2O与NH3为0.05mol.L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
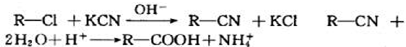
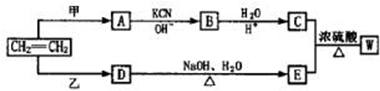
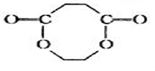 ,若W为一高分子化合物,其结构简式为
,若W为一高分子化合物,其结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
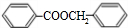 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com