
| A、①②③ | B、①② |
| C、②③ | D、②③④ |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、煤经过气化、液化等物理变化可得到清洁燃料 |
| B、棉花、羊毛、蚕丝都是由C、H、O元素构成 |
| C、食用冰糖和植物油的主要成分分别是蔗糖和甘油 |
| D、乙酸和乙酸乙酯可以用纯碱进行鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在晶体中只要有阳离子就一定有阴离子 |
| B、晶体中分子间作用力越大,分子越稳定 |
C、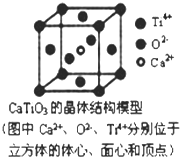 CaTiO3晶体中(晶胞结构如图所示)与每个Ti4+紧邻且等距的O2-有12个 |
| D、SiO2晶体中每个硅原子与两个氧原子以共价键相结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 X溶液与Y溶液反应的离子方程式为
X溶液与Y溶液反应的离子方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c (Na+)=c (HCO3-)+c (CO32-)+c (H2CO3) |
| B、c (Na+)+c (H+)=c (HCO3-)+c (CO32-)+c (OH-) |
| C、HCO3- 的电离程度大于HCO3-的水解程度 |
| D、其电离方程式为:NaHCO3?Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | ||
| Z | W |
| A、Y元素最高价氧化物对应的水化物化学式为H3YO4 |
| B、原子半径由小到大的顺序为X<Z<Y<W |
| C、与同浓度的盐酸反应,Z比W 更剧烈 |
| D、X、Z两种元素氧化物中所含化学键的类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
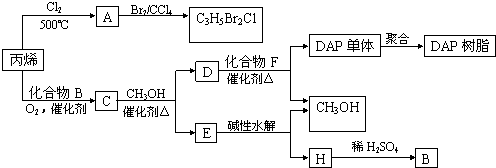
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com