
| A. | Na2CO3 NaHCO3 NaCl NH4Cl | |
| B. | Na2CO3 NaHCO3 NH4Cl NaCl | |
| C. | (NH4)2SO4 NH4Cl NaNO3 Na2S | |
| D. | NH4Cl (NH4)2SO4 Na2S NaNO3 |
分析 先是根据溶液的酸碱性将溶液分为三部分:酸性的、碱性的、中性的,再利用弱离子的水解程度:越弱越水解来比较浓度相同的溶液的pH大小即可.
解答 解:A.Na2CO3、NaHCO3均水解显碱性,碳酸钠水解程度大,碱性强,而NaCl为中性,NH4Cl水解显酸性,为pH由大到小的顺序排列,故A不选;
B.Na2CO3、NaHCO3均水解显碱性,碳酸钠水解程度大,碱性强,而NaCl为中性,NH4Cl水解显酸性,pH由小到大的排列顺序为:NH4Cl、NaCl、NaHCO3、Na2CO3,故B不选;
C.(NH4)2SO4、NH4Cl均水解显酸性,硫酸铵中铵根离子浓度大,水解后酸性强,pH最小,而NaNO3为中性,Na2S水解显碱性,为pH由小到大的顺序排列,故C选;
D.根据C可知,四种溶液的pH由小到大的顺序为:NH4)2SO4、NH4Cl、NaNO3、Na2S,故D不选;
故选C.
点评 本题考查了溶液pH的大小比较方法应用,把握离子水解的应用及溶液酸碱性与pH的关系为解答的关键,注意酸或是碱越弱,其阴离子水解程度越大,题目难度不大.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:选择题

| A. | 锌是负极,其质量逐渐减小 | B. | 氢离子在铜表面被还原 | ||
| C. | 电子从锌片经导线流向铜片 | D. | 电流从锌片经导线流向铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
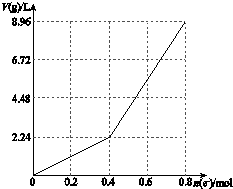 以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V(g)(标准状况)的关系如图所示.下列说法中,正确的是( )
以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V(g)(标准状况)的关系如图所示.下列说法中,正确的是( )| A. | 电解前CuSO4溶液的物质的量浓度为2 mol/L | |
| B. | 电解后所得溶液中c(H+)=1 mol/L | |
| C. | 当n(e-)=0.6 mol时,V(H2):V(O2)=2:3 | |
| D. | 向电解后的溶液中加入16 g CuO,则溶液可恢复为电解前的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| “嫦娥一号”发射火箭燃料 | 液氢(H2) | ①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 ②2H2(l)+O2(l)═2H2O(g)△H=-482.6kJ•mol-1 |
| 北京奥运会“祥云”火炬燃料 | 丙烷(C3H8) | ③C3H8(l)+5O2(g)═3CO2(g)+4H2O(g)△H=-2013.8kJ•mol-1 ④C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2221.5kJ•mol-1 |
| A. | -571.6 kJ•mol-1,-2221.5kJ•mol-1 | |
| B. | -285.8 kJ•mol-1,-2013.8 kJ•mol-1 | |
| C. | -285.8 kJ•mol-1,-2221.5 kJ•mol-1 | |
| D. | -241.3 kJ•mol-1,-2013.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
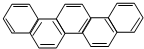
| A. | 该有机物属于苯的同系物 | |
| B. | 1mol该有机物最多可以和15molH2反应 | |
| C. | 该有机物的一氯代物有一种 | |
| D. | 该有机物完全燃烧生成H2O 的物质的量小于CO2的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+(2×283.0)kJ/mol | |
| C. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 | |
| D. | 稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验:
某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 加入氯化钠溶液 | C. | 加入Na2CO3溶液 | D. | 加入浓盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com