
| A. | 3和17 | B. | 1和8 | C. | 6和8 | D. | 7和12 |
分析 根据给定原子序数确定元素,然后确定原子的最外层电子数,由最外层电子数确定元素的化合价,再判断能否形成原子数之比为1:1共价化合物.
解答 解:A、原子序数为3的原子的最外层电子数为1,在化合物中元素的化合价为+1价,而序数为17的原子的最外层电子数为7,在化合物中元素的化合价为-1价,则能形成原子个数之比为1:1的离子化合物,故A错误;
B、原子序数为1,在化合物中元素的化合价为+1价;序数为8,最外层电子数为6,在化合物中元素的化合价为-2价,但可形成H2O2,则能形成原子数之比为1:1共价化合物,故B正确;
C、原子序数为6,最外层电子数为4,在化合物中元素的化合价为+4价;序数为8,最外层电子数为6,在化合物中元素的化合价为-2价,但可形成CO,则能形成原子数之比为1:1共价化合物,故C正确;
D、原子序数为7,最外层电子数为5,在化合物中元素的常见化合价为-3或+5价;而序数为12的原子,最外层电子数为2,在化合物中元素的化合价为+2价,则能形成Mg3N2原子数之比为3:2的离子化合物,故D错误;
故选AD.
点评 本题考查原子序数与质子数以及原子的结构的认识,题目难度不大,利用最外层电子数分析化合价来判断形成的化合物,并注意特殊情况,如过氧化氢,过氧化钠.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
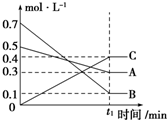 (1)T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示,根据图示可知:A与B反应生成C的化学方程式为A(g)+3B(g)?2C(g).
(1)T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示,根据图示可知:A与B反应生成C的化学方程式为A(g)+3B(g)?2C(g).| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
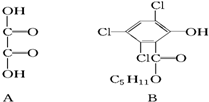 化合物A、B可合成荧光“魔棒”中产生能量的物质之一(CPPO).
化合物A、B可合成荧光“魔棒”中产生能量的物质之一(CPPO).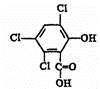 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | H-Cl | H-I | Cl-Cl | Br-Br |
| 键能/kJ/mol | 436 | 431 | 299 | 247 | 193 |
| A. | HCl | B. | HBr | C. | H2 | D. | Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 W、X、Y、Z、M、G六种主族元素分属三个短周期,且原子序数依次增大.Y是地壳中含量最多的元素;M与Y同主族;G与Z形成的化合物是厨房常用的调味品;X的简单气态氢化物水溶液呈碱性.请回答下列问题:
W、X、Y、Z、M、G六种主族元素分属三个短周期,且原子序数依次增大.Y是地壳中含量最多的元素;M与Y同主族;G与Z形成的化合物是厨房常用的调味品;X的简单气态氢化物水溶液呈碱性.请回答下列问题: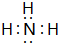 ,W、Y、Z、M、G形成的简单离子的半径大小顺序是S2->Cl->O2->Na+>H+(用相应的离子符号表示).
,W、Y、Z、M、G形成的简单离子的半径大小顺序是S2->Cl->O2->Na+>H+(用相应的离子符号表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中共消耗1.8 mol H2SO4 | B. | 气体甲中SO2与H2的体积比为4:1 | ||
| C. | 反应中共消耗97.5 g Zn | D. | 反应中共转移3 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com