
某稀溶液中含4mol KNO3和2.5mol H2SO4,向其中加入1.5mol Fe粉,充分反应后产生的NO气体在标准状况下的体积为( )
A.36 L
B.28 L
C.22.4 L
D.11.2 L
考点:化学方程式的有关计算.
分析:n(H+)=2.5mol×2=5mol,n(NO3﹣)=4,发生3Fe+2NO3﹣+8H+=3Fe2++2NO↑+4H2O或Fe+NO3﹣+4H+=Fe3++NO↑+2H2O,铁粉的物质的量为1.5mol,由离子方程式判断过量,以此计算该题.
解答: 解:n(H+)=2.5mol×2=5mol,n(NO3﹣)=4,铁粉的物质的量为1.5mol,
由 3Fe+2NO3﹣+8H+=3Fe2++2NO↑+4H2O,
3 2 8
1.5mol 0.1mol 4mol,
则1.5molFe完全反应时,硝酸根离子与氢离子均过量,
则发生Fe+NO3﹣+4H+=Fe3++NO↑+2H2O,
若1.5molFe完全反应时,氢离子不足,则两个反应均发生,
Fe+NO3﹣+4H+=Fe3++NO↑+2H2O
x 4x x
3Fe+2NO3﹣+8H+=3Fe2++2NO↑+4H2O
y 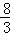 y
y  y
y
则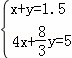 ,解得x=0.75mol,y=0.75mol
,解得x=0.75mol,y=0.75mol
生成NO的体积为(0.75mol+0.75mol× )×22.4L/mol=28L,
)×22.4L/mol=28L,
故选B.
点评:本题考查氧化还原反应的计算,为高频考点,把握反应中电子守恒为解答的关键,注意过量判断及发生的反应判断,侧重分析与计算能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列关于营养物质的说法正确的是( )
|
| A. | 油脂的氢化属于还原反应,又属于加成反应,生成物为纯净物 |
|
| B. | 氨基酸和蛋白质分子中都含有氨基和羧基,二者均有两性 |
|
| C. | 淀粉溶液和稀硫酸共热后发生水解反应,冷却后加少量银氨溶液,水浴加热后会出现光亮的银镜 |
|
| D. | 鸡蛋白溶液中加入浓硝酸溶液,出现白色沉淀,加热,沉淀变黄色,该过程叫作蛋白质的变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实能证明HClO是弱酸的是( )
A.HClO不稳定,易分解
B.HClO有强氧化性
C.HClO能使有机色质褪色
D.Ca(ClO)2与CO2及H2O反应生成HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定浓度的下列物质的澄清溶液中通入过量的CO2气体,最后肯定没有沉淀生成的是( )
①Ca(OH)2②Na2CO3③CaCl2④Ca(ClO)2⑤Na2SiO3.
A.①③④
B.②③④
C.①②③⑤
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
生活中常用到一些化学知识,下列说法中不正确的是 ( )
A.次氯酸钠溶液可用于环境的消毒杀菌
B.红葡萄酒营养丰富(含葡萄糖、维生素C等),常添加微量的二氧化硫,利用二氧化硫还原性,防止红葡萄酒中某营养成分被氧化。
C.某雨水放置一段时间后pH由4.68变为4.28,因为水中亚硫酸被空气中氧气氧化成硫酸
D.医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
滴加新制氯水后,下列各组离子还可能大量存在的是( )
A.Fe3+、Al3+、Cl-、NO3- B.K+、Na+、I-、SO42-
C.Ag+、Ca2+、NH4+、NO3- D.Na+、Ba2+、CO32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子,在指定条件下一定能大量共存的是( )
① 某无色透明的酸性溶液中:Cl-、Na+、MnO4—、SO42-
② 水电离产生的c(H+)=10-12mol·L-1的溶液中:K+、Na+、Cl-、NO3-
③ 使紫色石蕊试液变红的溶液中:Fe2+、Mg2+、NO3-、Cl-
④ 加入过量NaOH溶液后可得到澄清溶液:K+、Ba2+、 HCO3-、C1-
⑤ c(H+)<c(OH-)的溶液中:SO32—、S2-、K+、Na+
⑥ 在酸性高锰酸钾溶液中:Na+、NH4+、I-、ClO-
⑦ 能使pH试纸变深蓝色的溶液中:Na+、AlO2-、K+、CO32-
A.①③④⑥⑦ B.②③⑤⑦ C.②⑤⑦ D.②④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
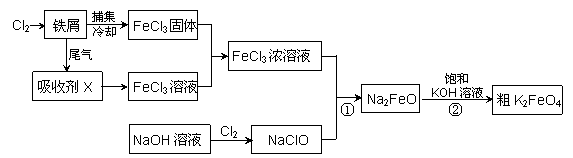 氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
请回答下列问题:
(1)氯化铁有多种用途,请用离子方程式表示下列用途的原理。
①氯化铁做净水剂______________________;
②用FeCl3溶液(32%~35%)腐蚀铜印刷线路板____________________________。
(2)吸收剂X的化学式为 。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式 为2KOH+Na2FeO4
为2KOH+Na2FeO4 K2FeO4+2NaOH ,请根据复分解反应原理分析反应发生的原因
K2FeO4+2NaOH ,请根据复分解反应原理分析反应发生的原因

 。
。
(5)K2FeO4 在水溶液中易发生反应:4FeO42-+10H2O  4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
A.H2O B.稀KOH溶液、异丙醇
C.NH4Cl溶液、异丙醇 D.Fe(NO3)3溶液、异丙醇
(6)可用滴定分析法测定粗K2FeO4的纯度,有关反应离子方程式为:
①FeO42-+CrO2- +2H2O CrO42-+Fe(OH)3↓+OH-
CrO42-+Fe(OH)3↓+OH-
②2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
③Cr2O72 -+6Fe2++14H+ 2Cr3++6Fe3++7H2O
2Cr3++6Fe3++7H2O
现称取1.980 g粗高铁酸钾样品溶于适量氢氧化钾溶液中,加入稍过量的KCrO2,充分反应后过滤,滤液定容于250 mL容量瓶中。每次取25.00 mL加入稀硫酸酸化,用0.1000 mol/L的(NH4)2Fe(SO4) 2标准溶液滴定,三次滴定消耗标准溶液的平均体积为18.93 mL。则上述样品中高铁酸钾的质量分数为 。
2标准溶液滴定,三次滴定消耗标准溶液的平均体积为18.93 mL。则上述样品中高铁酸钾的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com