
以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:
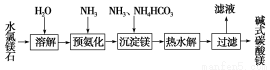
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6 mol·L-1,则溶液中c(Mg2+)= 。
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式
(3)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁4.66 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO2 0.896 L,通过计算确定碱式碳酸镁的化学式。
(4)若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数 (填“升高”、“降低”或“不变”)。
(1)2.0 mol·L-1
(2)NH4Cl
(3)n(CO2)= =4.00×10-2 mol
=4.00×10-2 mol
n(MgO)= =5.00×10-2 mol
=5.00×10-2 mol
n(H2O)= =5.00×10-2 mol
=5.00×10-2 mol
n(MgO)∶n(CO2)∶n(H2O)=5.00×10-2∶4.00×10-2∶5.00×10-2=5∶4∶5
碱式碳酸镁的化学式为Mg(OH)2·4MgCO3·4H2O
(4)升高
【解析】(1)Ksp=c(Mg2+)·c2(OH-),则c(Mg2+)= =
= =2.0 (mol·L-1)。
=2.0 (mol·L-1)。
(2)滤液中的溶质主要成分为NH4Cl,可根据元素守恒解答该题。
(4)Mg(OH)2·4MgCO3·4H2O中Mg的质量分数为: ×100%=25.75%,MgCO3中Mg的质量分数为:
×100%=25.75%,MgCO3中Mg的质量分数为: ×100%=28.57%,所以产品中混有MgCO3,则Mg的质量分数升高。
×100%=28.57%,所以产品中混有MgCO3,则Mg的质量分数升高。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷二(解析版) 题型:选择题
下列有机反应中,不属于取代反应的是( )
A.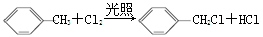
B.2CH3CH2OH+O2 2CH3CHO+2H2O
2CH3CHO+2H2O
C.ClCH2CH=CH2+NaOH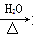 HOCH2CH=CH2+NaCl
HOCH2CH=CH2+NaCl
D.
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练9-2练习卷(解析版) 题型:填空题
如图为相互串联的甲乙两个电解池,X、Y为直流电源的两个电极。电解过程中,发 现石墨电极附近先变红。请回答:
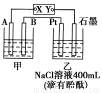
(1)电源X极为 极(填“正”或“负”),乙池中Pt电极上的电极反应式为 。
(2)甲池若为电解精炼铜的装置,其阴极增重12.8 g,则乙池中阴极上放出的气体在标准状况下的体积为 ,电路中通过的电子为 mol。
(3)在(2)的情况下,若乙池剩余溶液的体积仍为400 mL,则电解后所得溶液c(OH-)= 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练9-1练习卷(解析版) 题型:填空题
如图所示,在不同的电解质溶液中可以组成不同的电池。
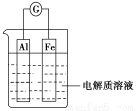
(1)①当电解质溶液为稀硫酸时,Fe电极是 (填“正”或“负”)极,其电极反应式为
。
②当电解质溶液为NaOH溶液时,Al电极是 (填“正”或“负”)极,其电极反应式为 。
(2)若把铝改为锌,电解质溶液为浓硝酸,则Fe电极是 (填“正”或“负”)极,其电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练9-1练习卷(解析版) 题型:选择题
生物燃料电池(BFC)是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化效率高,是一种真正意义上的绿色电池,其工作原理如图所示。
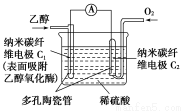
已知C1极的电极反应式为:C2H5OH+3H2O-12e-=2CO2+12H+。下列有关说法不正确的是( )
A.C1极为电池负极,C2极为电池正极
B.电子由C2极经外电路导线流向C1极
C.C2极的电极反应式为O2+4H++4e-=2H2O
D.该生物燃料电池的总反应式为:C2H5OH+3O2=2CO2+3H2O
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-4练习卷(解析版) 题型:选择题
将氨水滴加到盛有AgCl浊液的试管中,AgCl逐渐溶解,再加入NaBr溶液又产生了浅
黄色沉淀。对上述过程,下列理解或解释中正确的是( )
A.Ksp(AgCl)<Ksp(AgBr)
B.若在AgCl浊液中直接加入NaBr溶液,也会产生浅黄色沉淀
C.上述实验说明AgCl没有NaBr稳定
D.因为Ksp(AgCl)>Ksp(AgOH),故氨水能使AgCl溶解
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-4练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.难溶电解质作比较时,Ksp小的,溶解度一定小
B.Ksp大小取决于难溶电解质的量,所以离子浓度改变时,沉淀溶解平衡会发生移动
C.所谓沉淀完全就是用沉淀剂将溶液中某一离子完全除去
D.温度一定,当溶液中Ag+和Cl-浓度的乘积等于Ksp时,溶液为AgCl的饱和溶液
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-2练习卷(解析版) 题型:填空题
已知:常温下,A酸的溶液pH=a,B碱的溶液pH=b。
(1)若A为盐酸,B为氢氧化钡,且a=3,b=11,两者等体积混合,溶液的pH为 。
a.大于7 b.等于7 c.小于7
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为 mol/L,B溶液中水电离出的氢离子浓度为 mol/L。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练7-2练习卷(解析版) 题型:填空题
一定条件下,体积为1 L的密闭容器中发生如下反应:SiF4(g)+2H2O(g)  SiO2(s)+4HF(g) ΔH=+148.9 kJ·mol-1。
SiO2(s)+4HF(g) ΔH=+148.9 kJ·mol-1。
(1)下列各项中能说明该反应已达化学平衡状态的是________(填字母序号)。
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示。
反应时间/min | n(SiF4)/mol | n(H2O)/mol |
0 | 1.20 | 2.40 |
t1 | 0.80 | a |
t2 | b | 1.60 |
通过a或b的值及化学平衡原理说明t1时反应是否达到化学平衡状态:________。
(3)若只改变一个条件使上述反应的化学平衡常数变大,该反应________(填序号)。
a.一定向正反应方向移动
b.一定向逆反应方向移动
c.一定是减小压强造成的
d.一定是升高温度造成的
e.SiF4的平衡转化率一定增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com