
| A. | Fe2+ | B. | Mg2+ | C. | Cl- | D. | Ba2+ |
分析 根据溶液的电中性可以确定未知离子为阳离子,然后利用离子不能结合生成水、气体、沉淀等,不能发生氧化还原反应,确定未知离子,以此来解答.
解答 解:由物质的量之比为n(NO3-):n(SO42-):n(Fe3+):n(H+):n(未知)=2:3:1:3:1,
由于溶液不显电性,则:2×1+3×2>1×3+3×1,
则未知离子为阳离子,由电荷守恒可知,未知离子为带两个单位正电荷的阳离子,
又Fe2+、NO3-、H+发生氧化还原反应、硫酸根离子能够与钡离子生成难溶物硫酸钡,
则未知阳离子为Mg2+,
故选B.
点评 本题考查溶液为电中性及离子的共存,注意阳离子的电荷总数等于阴离子电荷总数确定M为阳离子是解答本题的关键,并注意发生的氧化还原反应,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 称量NaOH固体时动作过于缓慢 | B. | 向容量瓶中加水定容时俯视 | ||
| C. | 有少量NaOH溶液残留在烧杯里 | D. | 称量时误用“左码右物” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
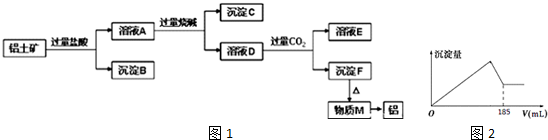
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水合肼(N2H4•H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为:
水合肼(N2H4•H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.4g H2O2中含有的共用电子对数为0.1NA | |
| B. | 标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2 NA | |
| C. | 标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1 NA | |
| D. | 25℃,pH=13的NaOH溶液中,含有OH-的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果容器内压强不再改变,则证明该反应已达到平衡状态 | |
| B. | 寻找合适的催化剂是加快反应速率并提高CO2产率的有效措施 | |
| C. | 当反应达到平衡后,保持容器内体积不变,再向其中充入CO和H2O(g)各1 mol,达到新的平衡后CO2的产率会增大 | |
| D. | 如果在某温度下平衡常数为9.0,则平衡时CO转化率为75% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
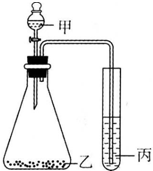
| A. | 甲-盐酸,乙-石灰石,丙-硅酸钠溶液,证明酸性:盐酸>H2CO3>H2SiO3 | |
| B. | 甲-盐酸,乙-亚硫酸钠,丙-溴水,证明还原性:HCI>SO2>HBr | |
| C. | 甲-浓盐酸,乙-高锰酸钾,丙-溴化钾,证明氧化性:KMnO4>Cl2>Br2 | |
| D. | 甲-氯化铵饱和溶液,乙-烧碱,丙-氯化铝,证明碱性:NaOH>NH3•H2O>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “钴酞菁”分子既不能透过滤纸,又不能透过半透膜,混有氯化钠的“钴酞菁”可用渗析的方法净化 | |
| B. | “钴酞菁”与水所形成的分散系具有丁达尔效应 | |
| C. | 此项工作可以用来改变分子的某些物理性质 | |
| D. | 此项工作可广泛应用于光电器件、生物技术等方面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com