
本题分三个部分,分别完成以下问题:
I. 下面列出了几组物质或粒子,请将合适的组号填写在空格上。
①金刚石与“足球烯”(C60)
②CH3CH2CH2CH(C2H5)CH3 和 CH3CH2CH2CH(CH3)C2H5
③235U、238U ④氧气(O2)与臭氧(O3)
⑤乙醇(CH3CH2OH)和甲醚(CH3OCH3) ⑥淀粉和纤维素
⑦ 
(1)是同素异形体的是 ,(填序号,下同)
(2)是同位素的是 ,
(3)是同分异构体的是 ,
(4)是同一物质的是 。
II. 下列物质:①Cl2 ②Na2O2 ③NaOH ④HCl ⑤C2H6 ⑥MgF2 ⑦HNO3
(1)只由离子键构成的物质是______________(填序号,下同)(2)由离子键和非极性键构成的物质是______________(3)由极性键和非极性键构成的物质是______________
III. 提纯下列物质(括号内的物质是杂质),请将所选用的除杂试剂和分离方法(填字母或者序号)填入对应的空格中(若不选,填“无”)
除杂试剂:A. 盐酸 B. 酸性高锰酸钾 C. 氢氧化钠溶液 D. (浓)溴水
E. H2(催化剂) F. CaO G. NaCl
分离方法:① 蒸馏 ② 分液 ③ 洗气 ④ 过滤
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| (1) | 酒精(水) | ||
| (2) | 乙烷(乙烯) | ||
| (3) | 硬脂酸钠溶液(甘油) | ||
| (4) | 苯(苯酚) | ||
| (5) | SiO2(Al2O3) |
【知识点】化学用语,物质的结构,物质的除杂 A4 E3 J2
【答案解析】I. (1)①④ (2) ③ (3) ⑤ (4)②⑦
II. (1)⑥ (2)② (3)⑤
III.
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| (1) | 酒精(水) | F | ① |
| (2) | 乙烷(乙烯) | D | ③ |
| (3) | 硬脂酸钠溶液(甘油) | G | ④ |
| (4) | 苯(苯酚) | C | ② |
| (5) | SiO2(Al2O3) | A | ④ |
解析:I、同素异形体是同一种元素形成的不同种物质,故有①④;同位素是质子数相同、中子数不同的同一元素形成的不同原子,故为③;同分异构体是相同的分子式、不同的结构的有机物之间的关系,故为⑤;是同一物质的是②⑦。
II.在⑥MgF2在只存在着离子键;在②Na2O2既由离子键又有共价键;在⑤C2H6中既由极性键和非极性键。
III. (1) 酒精中的水选用CaO和水发生反应然后进行蒸馏的方法;(2) 乙烷中的乙烯除杂的方法可以让混合气体通过溴水,乙烯和溴发生加成反应生成1,2—二溴乙烷存在在溶液中而除去乙烯;(3) NaCl可以降低甘油在硬脂酸钠溶液的溶解度而除去;(4)苯酚可以与碱液发生反应生成易溶于水的物质,而苯是难溶于水的,在利用分液的方法除去;(5) Al2O3是两性物质,而SiO2是酸性氧化物,故可以采用盐酸进行除杂。
【思路点拨】本题考查了化学基本用语、物质的结构、物质的除杂,涉及的知识点比较多,基础性较强。


科目:高中化学 来源: 题型:
下列有关物质用途的说法错误的是( )
|
| A. | 过氧化钠可用作潜艇里氧气的来源 | B. | 单质硅是光导纤维的主要成分 |
|
| C. | 乙醇可用作燃料 | D. | 食醋可用于清除暖水瓶中的水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各电离方程式中,书写正确的是 ( )
A.CH3COOH 
 H++CH3COO-
H++CH3COO-
B.KHSO4 
 K++H++SO
K++H++SO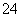
C.Al(OH)3===Al3++3OH-
D.NaH2PO4 
 Na++H2PO
Na++H2PO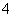
查看答案和解析>>
科目:高中化学 来源: 题型:
将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为____________;经测定溶液中含CH3COO-为1.4×10-3 mol/L,此温度下醋酸的电离常数:Ka=________,温度升高电离平衡向 移动,Ka将________(填“变大”“不变”或“变小”下同);加水稀释CH3COOH的电离程度 ,Ka将________。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏伽德罗常数,下列叙述错误的是
A.常温常压下,42g乙烯和丁烯混合气体中,极性键数为 6 NA
B.1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2 NA个电子
C.由CO2和O2组成的混合气体中共有NA个分子,其中的氧原子数为2NA
D.6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列说法正确的是
A.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
B.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积约为22.4L
C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA
D.25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸铜是一种应用极其广泛的化工原料。铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)。
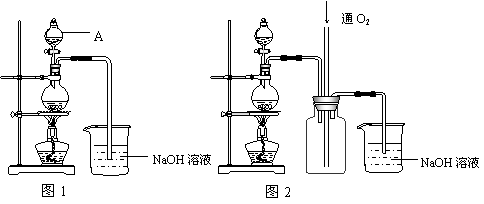

(1)图1烧瓶中发生的离子反应方程式为:
(2)图2是图1的改进装置,其优点有:
① ;② 。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加FeSO4或Fe2(SO4)3,即发生反应。反应完全后向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤.蒸发.结晶,滤渣作催化剂循环使用。(已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7.6.4。)
请回答下列问题:
①方案1中的B仪器名称是 。
②方案2中甲物质是 (填字母序号)。a.CaO b.CuCO3 c.CaCO3 d.NH3▪H2O
以加入FeSO4为例,用离子方程式解释反应发生的原因
。
方案3 :将3.2g铜丝放到45 mL 1.5mol/L的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5小时后,升温到60℃,持续反应1 小时后,过滤.蒸发结晶.减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O10.6g。
③上述三种方案中,更符合绿色化学理念的是 ,(填方案1、方案2、方案3)
理由是 . . 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在t℃下,某反应达到平衡,平衡常数K= 。恒容时,温
。恒容时,温 度升高,NO浓度减小。下列说法正确的是 ( )
度升高,NO浓度减小。下列说法正确的是 ( )
A.该反应的焓变为正值 B.K表达式中,C(SO3)指反应在该条件下达到化学平衡时SO3的物质的量浓度
C.升高温度,逆反应速率减小 D.该反应化学方程式为:NO+SO3 NO2+SO2
NO2+SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com