
| A、Na2O2﹑CaO﹑K2O都是碱性氧化物 |
| B、BaSO4﹑NaCl﹑KNO3溶液都是电解质 |
| C、纯碱﹑烧碱﹑碱石灰都是碱 |
| D、稀豆浆﹑果冻﹑淀粉溶液都是胶体 |


科目:高中化学 来源: 题型:
| A、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH- | ||||
B、向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-
| ||||
| C、将过量二氧化碳通入氨水中:CO2+NH3?H2O=HCO3-+NH4+ | ||||
| D、用稀硝酸洗涤试管内壁的银镜:Ag+2H++3NO3-=Ag++3NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
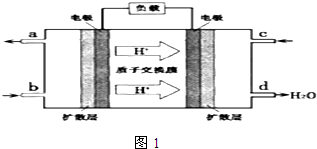 PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx
PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx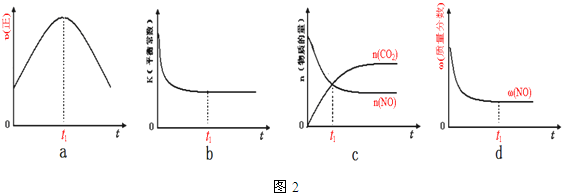
查看答案和解析>>
科目:高中化学 来源: 题型:
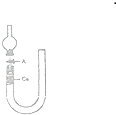 现用U型管(用硬质玻璃管弯制)、干燥管、酒精灯、胶囊和玻璃导管等仪器设计下图装置来证实稀硝酸与铜反应生成NO
现用U型管(用硬质玻璃管弯制)、干燥管、酒精灯、胶囊和玻璃导管等仪器设计下图装置来证实稀硝酸与铜反应生成NO查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
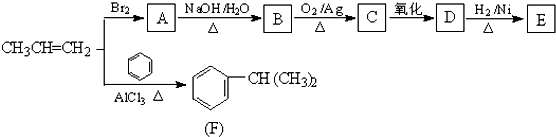
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com