
【题目】现有中学化学常见四种金属单质A、B、C、I和三种常见气体甲、乙、丙及物质D、E、F、G、H.它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出) 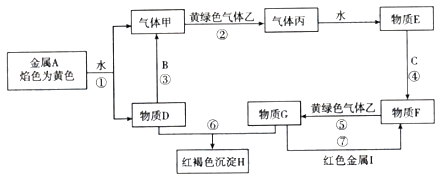
请根据以上信息回答下列问题:
(1)写出物质H的化学式: , 物质E的名称:;
(2)写出反应①的离子方程式;写出反应③的化学方程式;写出反应⑦的离子方程式 .
【答案】
(1)Fe(OH)3;盐酸
(2)2Na+2H2O=2Na++2OH﹣+H2↑;2Al+2Na+2H2O=2NaAlO2+3H2↑;2Fe3++Cu=2Fe2++Cu2+
【解析】解:(1)由上面的分析可知,H的化学式为Fe(OH)3 , 物质E的名称为盐酸,所以答案是:Fe(OH)3; 盐酸;(2)反应①为Na与水反应生成氢氧化钠和氢气,离子方程式为2Na+2H2O=2Na++2OH﹣+H2↑;反应③为铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,化学方程式为2Al+2Na+2H2O=2NaAlO2+3H2↑;
反应⑦为FeCl3与Cu反应生成FeCl2 , 离子方程式为2Fe3++Cu=2Fe2++Cu2+ ,
所以答案是:2Na+2H2O=2Na++2OH﹣+H2↑;2Al+2Na+2H2O=2NaAlO2+3H2↑;2Fe3++Cu=2Fe2++Cu2+ .


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列物质的转化中,不能通过—步化学反应实现的是
A. Fe—Fe3O4 B. C2H2—CO2 C. CH2=CH2→CH3CH3 D. A12O3→Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.多糖、油脂、蛋白质均为高分子化合物
B.淀粉和纤维素水解的最终产物均为葡萄糖
C.可用酸性 KMnO4 溶液鉴别苯和环己烷
D.分离溴苯和苯的混合物:加入 NaOH 溶液分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于配合物[Zn(NH3)4]Cl2的说法正确的是( )
A.配位数为6
B.配体为NH3和Cl﹣
C.[Zn(NH3)4]2+为内界
D.Zn2+和NH3以离子键结合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=﹣99kJmol﹣1 .
请回答下列问题:
(1)图中A、C分别表示、 , E的大小对该反应的反应热有无影响? . 该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? , 理由是;
(2)图中△H=kJmol﹣1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化.写出该催化循环机理的化学方程式;
(4)如果反应速率υ(SO2)为0.05molL﹣1min﹣1 , 则υ(O2)=molL﹣1min﹣1、υ(SO3)=molL﹣1min﹣1;
(5)已知单质硫的燃烧热为296kJmol﹣1 , 计算由S(s)生成3molSO3(g)的△H(要求计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+ . AgNO2是一种难溶于水、易溶于酸的化合物.试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+ . 若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是(填序号).
A.亚硝酸盐被还原
B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+
D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是(填序号).
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI﹣淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,请写出反应的离子方式: .
(4)Fe与过量稀硫酸反应可以制取FeSO4 . 若用反应所得的酸性溶液,将Fe2+转化为Fe3+ , 要
求产物纯净,可选用的最佳试剂是(填序号).
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2:1,试配平下列方程式:
FeSO4+K2O2→ K2FeO4+K2O+K2SO4+O2↑
当转移了1.5NA个电子时,在标况下可收集到 L氧气.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是从铝士矿(主要成分为Al2O3 , 还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程: 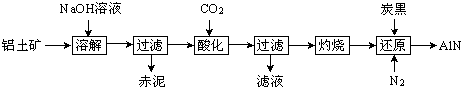
(1)“溶解”时,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O═Na2Al2Si2O8↓+4NaOH 赤泥的主要成分为(写出化学式).
(2)“酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3 , 滤液的主要成分为(写出化学式).实验室过滤需用到的玻璃仪器有烧杯、、玻璃棒.
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为 .
(4)现取三份不同质量的氮化铝样品(假设杂质只含有炭黑)分别加到20.00mL相同浓度的NaOH溶液中,充分反应后,测得实验数据如表所示. (已知:AlN+NaOH+H2O═NaAlO2+NH3↑)
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入氮化铝样品的质量/g | 4.1 | 8.2 | 12.3 |
生成氨气的体积/L(标准状况) | 1.456 | 2.912 | 4.256 |
①该样品中AlN的质量分数为多少?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对四种无色溶液进行离子检验,实验结果如下,其中明显错误的是
A. K+、Na+、Cl-、NO3- B. K+、NO3-、OH-、HCO3-
C. Na+、OH-、Cl-、NO3- D. MnO4-、K+、S2-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X2(g)+Y2(g)![]() 2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
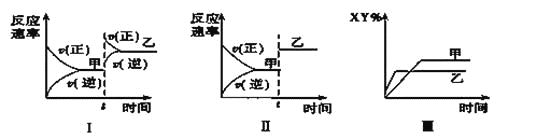
A. 图Ⅰ是增大压强的变化情况
B. 图Ⅱ是一定是加入催化剂的变化情况
C. 图Ⅲ是增大压强或升高温度的变化情况
D. 图Ⅲ一定是升高温度的变化情况
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com