
【题目】某实验小组欲用酸性KMnO4和H2C2O4反应通过测定单位时间内生成 CO2的量来探究影响反应速率的因素,设计实验方案如下:
实验序号 | A 溶液 | B 溶液 |
① | 20 mL 0.1 molL-1 H2C2O4 溶液 | 30 mL 0.01 molL-1 KMnO4 酸性溶液 |
② | 20 mL 0.2 molL-1 H2C2O4 溶液 | 30 mL 0.01 molL-1 KMnO4 酸性溶液 |

(1)检验上图装置气密性的最简便方法为:____________。
(2)H2C2O4溶液与酸性 KMnO4溶液反应的化学方程式为____________。
(3)该实验探究的是___________因素对化学反应速率的影响,相同时间内针筒中所得CO2的体积大小关系是___________(填实验序号)。
(4)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO4-)=________(若忽略溶液混合前后体积的变化)。
(5)小组同学发现反应速率总是如上右图所示,积极探究t1~t2时间内速率变快的主要原因,提出假设可能是:①__________、②_________、③K+对该反应有催化作用。
【答案】
(1)先关闭分液漏斗的活塞,再轻轻向外拉(或向内压)注射器的活塞,松手后恢复原位,表明气密性良好。
(2)2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(3)浓度;②>①
(4)0.0052mol/L
(5)该反应为放热反应;反应生成的Mn2+对该反应有催化作用
【解析】
试题分析:(1)检验该装置气密性最简单的方法是:先关闭分液漏斗的活塞,再轻轻向外拉(或向内压)注射器的活塞,松手后恢复原位,表明气密性良好。
(2)酸性高锰酸钾溶液中含有硫酸,H2C2O4溶液与酸性 KMnO4溶液反应生成二氧化碳、硫酸锰、硫酸钾和水,配平后可得该反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4= K2SO4+2MnSO4 + 10CO2 ↑+ 8H2O。
(3)对比①②实验可探究浓度对化学反应速率的影响,②中A溶液的浓度比①中大,化学反应速率大,所得CO2的体积大。
(4)CO2的物质的量是:4.48mL×10-322.4mol/l=0.0002mol,设2min末,反应(MnO4-)为X
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
2 10
X 0.0002mol
解得 X=0.00004mol,
30mL×10-3×0.01molL-1-0.00004mol=0.00026mol
C(MnO4-)=nv=0.00026mol0.05L=0.0052mol/L
故答案为:0.0052mol/L;
(5)温度升高,化学反应速率加快,若该反应为放热反应,则速率变化与图像相符;催化剂能加快化学反应的速率,产物Mn2+(或MnSO4)是反应的催化剂。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是______(填字母序号)。
a. Fe b. FeO c. Fe3O4 d. Fe2O3
(2) 现代利用铁的氧化物循环裂解水制氢气的过程如下图所示。 整个过程与温度密切相关, 当温度低于 570℃时,反应Fe3O4(s)+4 CO(g)![]() 3Fe(s)+4 CO2(g),阻碍循环反应的进行。
3Fe(s)+4 CO2(g),阻碍循环反应的进行。
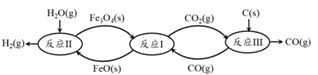
① 已知:Fe3O4(s) + CO(g) ![]() 3FeO(s) +CO2(g) ΔH1 = +19.3 kJ·mol-1
3FeO(s) +CO2(g) ΔH1 = +19.3 kJ·mol-1
3FeO(s) + H2O(g)![]() Fe3O4(s) + H2(g) ΔH2 =-57.2 kJ·mol-1
Fe3O4(s) + H2(g) ΔH2 =-57.2 kJ·mol-1
C(s)+CO2![]() 2CO(g) ΔH3 =+172.4 kJ·mol-1 。
2CO(g) ΔH3 =+172.4 kJ·mol-1 。
铁氧化物循环裂解水制氢气总反应的热化学方程式是_________。
② 下图表示其他条件一定时, Fe3O4(s)和 CO(g)反应达平衡时 CO(g)的体积百分含量随温度的变化关系。
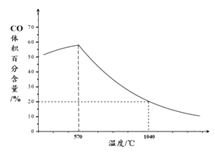
i. 当温度低于570℃时,温度降低CO的转化率____(填“增大”、“减小”或“不变”),理由是______。
ii. 当温度高于570℃时,随温度升高,反应 Fe3O4(s) + CO(g) ![]() 3FeO(s) + CO2(g)平衡常数的变化趋势是________;(填“增大”、“减小”或“不变”)1040℃时,该反应的化学平衡常数的数值是________。
3FeO(s) + CO2(g)平衡常数的变化趋势是________;(填“增大”、“减小”或“不变”)1040℃时,该反应的化学平衡常数的数值是________。
(3)① 古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应 ii 的离子方程式是_______________。
② 如今基于普鲁士蓝合成原理可检测食品中 CN-,方案如下:
![]()
若试纸变蓝则证明食品中含有 CN-,请解释检测时试纸变蓝的原因_________。
(4)已知25℃时,Kap[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配置100mL 5mol/LFeCl3溶液,为使配置过程中不出现浑浊现象,则至少需要加入2mol/L的盐酸_________mL(忽略加入盐酸体积)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为KW。该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定混合溶液呈中性的依据是
A.a = b B.pH = 7
C.c(H+) = ![]() mol/L D.c(H+) + c(B-) = c(OH-) + c(A-)
mol/L D.c(H+) + c(B-) = c(OH-) + c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量转换的说法正确的是( )
A.煤燃烧是化学能转化为热能的过程
B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,将2mol X、2mol Y分别充入到不同体积的容器中,发生反应:X(g)+Y (g)![]() mZ(g) ΔH,所得Z的平衡浓度如表所示,下列说法正确的是( )
mZ(g) ΔH,所得Z的平衡浓度如表所示,下列说法正确的是( )
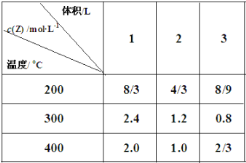
A.m=2 ,ΔH>0
B.300℃时,该反应平衡常数 K=9
C.在3L容器中进行反应,达到平衡的时间:400℃>200℃
D.200℃,2L容器中反应达平衡后,再充入2 mol Z,平衡时 Z 的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池工作时发生复杂的铜腐蚀现象,电池总反应为:2Li+Cu2O+H2O=2Cu+2Li++2OH,其工作原理如图所示,下列说法不正确的是
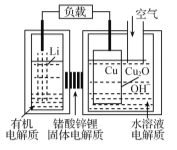
A.电池放电时,正极附近溶液pH增大
B.工作时,Li+透过固体电解质向Cu极移动
C.电池放电过程中,空气中的O2并不参加反应
D.两极的有机电解质和水溶液电解质不可对换
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施不合理的是
A. 用SO2漂白纸浆和草帽辫
B. 用硫酸清洗锅炉中的水垢
C. 高温下用焦炭还原SiO2制取粗硅
D. 用Na2S作沉淀剂,除去废水中Cu2+和Hg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据提供条件推断元素,并按要求填空:
(1)原子核外有3个电子层,其价电子数为7,最高价氧化物对应水化物化学式________,其单质与NaOH反应的化学方程式为_________________________。
(2) 已知X+、Y2+、Z—、W2—四种离子均具有相同的电子层结构,则X、Y、Z、W这四种元素的原子序数由大到小的顺序是_______________,原子半径由大到小的顺序是 。
(3)A+、B—、C、D 四种粒子(分子或离子),它们都分别含10个电子,已知它们有如下转化关系:A++B—![]() C+D↑,则标出A+、B—的电子式 , ;比较C和D的稳定性的强弱大小 (用化学式表示)
C+D↑,则标出A+、B—的电子式 , ;比较C和D的稳定性的强弱大小 (用化学式表示)
(4) ①NH4NO3②NaF ③CO2④K2O2⑤NaOH ⑥CH4
只含有极性键的是________,既有离子键又有非极性键的是______;既有离子键又有极性键的是______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com