
 盐泥是氯碱工业中的废渣,主要含有镁、铁、铝、钙等的硅酸盐和碳酸盐.实验室以盐泥为原料制取MgSO4•7H2O的流程如下:[29g盐泥]$→_{②H_{2}SO_{4}调pH=1-2}^{①水,调成泥浆}$$→_{④过滤}^{③煮沸}$[滤液Ⅰ]$→_{⑥煮沸,趁热}^{⑤加NaClO,pH=5~6}$[滤液Ⅱ]→产品
盐泥是氯碱工业中的废渣,主要含有镁、铁、铝、钙等的硅酸盐和碳酸盐.实验室以盐泥为原料制取MgSO4•7H2O的流程如下:[29g盐泥]$→_{②H_{2}SO_{4}调pH=1-2}^{①水,调成泥浆}$$→_{④过滤}^{③煮沸}$[滤液Ⅰ]$→_{⑥煮沸,趁热}^{⑤加NaClO,pH=5~6}$[滤液Ⅱ]→产品分析 (1)根据离子完全沉淀的pH值来确定在盐泥中加入稀硫酸调pH为1~2并煮沸的目的;
(2)根据氢氧化镁的Ksp=c(Mg2+)•c(OH-)2来计算;
(3)根据三种化合物的溶解度(S)随温度变化的曲线来回答;
(4)镁离子可以和氢氧化钠发生反应生成氢氧化镁沉淀,过滤,得到纯净的沉淀,再加入硫酸,蒸发结晶可以获得硫酸镁晶体;
(5)根据镁元素守恒结合关系式:MgSO4•7H2O-Mg(OH)2进行计算.
解答 解:(1)根据离子完全沉淀的pH值可以知道,在盐泥中加入稀硫酸调pH为1~2并煮沸的目的是为了提高Mg2+的浸取率,故答案为:为了提高Mg2+的浸取率;
(2)氢氧化镁的Ksp=c(Mg2+)•c(OH-)2,溶液中Mg2+的浓度为6.0mol•L-1,则溶液的c(OH-)=$\sqrt{\frac{6.0×1{0}^{-12}}{6.0}}$=10-6mol/L,所以氢离子浓度为10-8mol/L,pH为8,故答案为:8;
(3)温度较高时钙盐与镁盐分离得更彻底,或者根据三种化合物的溶解度(S)随温度变化的曲线,可以知道高温下CaSO4•2H2O溶解度小,所得到的滤渣主要成分是:Al(OH)3、Fe(OH)3、CaSO4•2H2O,
故答案为:温度较高时钙盐与镁盐分离得更彻底(或高温下CaSO4•2H2O溶解度小等合理答案均可);Al(OH)3、Fe(OH)3、CaSO4•2H2O;
(4)镁离子可以和氢氧化钠发生反应生成氢氧化镁沉淀,过滤,得到纯净的沉淀,再加入硫酸,蒸发结晶可以获得硫酸镁晶体,故答案为:NaOH溶液;向沉淀中加足量稀硫酸;
(5)设该盐泥中含Mg(OH)2的质量为X,MgSO4•7H2O质量为24.6克,物质的量是0.1mol,由关系式MgSO4•7H2O-Mg(OH)2可知,Mg(OH)2的质量为0.1mol×58g/mol=5.8g,故该盐泥中含Mg(OH)2的百分含量为$\frac{5.8g}{29g}$×100%=20.0%,故答案为:20.0%.
点评 本题考查制备实验,为高频考点,把握物质的性质、反应原理及混合物分离方法为解答的关键,侧重分析与实验及计算能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3与过量NaOH溶液反应生成AlO2-,则与过量NH3•H2O也生成AlO2- | |
| B. | Mg可以常温下被氧气氧化,Al也可以常温下被氧气氧化 | |
| C. | Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3 | |
| D. | Fe与S能反应生成FeS,则Cu与S也能反应生成CuS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol 最多能与8molNaOH发生反应 最多能与8molNaOH发生反应 | |
| B. | 甲苯既能跟溴水反应又能跟酸性高锰酸钾溶液反应 | |
| C. | 向苯酚钠溶液中通入少量的CO2气体,发生反应的离子方程式为: 2 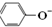 +H2O+CO2→2 +H2O+CO2→2 +CO${\;}_{3}^{2-}$ +CO${\;}_{3}^{2-}$ | |
| D. | 1mol 最多能和4molH2发生反应 最多能和4molH2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 50mL 0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
50mL 0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com