
| A. |  表示在恒容密闭容器中,恒温条件下发生的可逆反应2NO2(g)?N2O4(g),各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| B. | 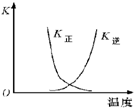 曲线表示反应2A(g)+B(g)?2C(g)△H>0,正、逆反应的平衡常数K随温度的变化 | |
| C. |  表示对反应2X(g)+Y(g)?Z(s)+3W(g)△H<0 在t1时刻增大压强 | |
| D. | 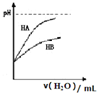 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液pH |
分析 A、可逆反应2NO2?N204(g)中,分析判断 二氧化氮消耗速率和四氧化二氮的消耗速率之比为2:1,说明反应达到平衡状态;
B、该反应为吸热反应,温度越高正反应平衡常数越大,逆反应平衡常数越小;
C、反应2X(g)+Y(g)?Z(s)+3W(g)△H<0 是前后气体系数和相等的反应,压强不会引起平衡的移动;
D、稀释等pH的两种酸,稀释相同倍数时,pH变化越快的酸酸性越强,等浓度的钠盐溶液,弱酸的钠盐溶液pH大.
解答 解:A、可逆反应2NO2?N204(g)中,分析判断,二氧化氮消耗速率和四氧化二氮的消耗速率之比为2:1时才能说明反应达到平衡状态,交点只是浓度相同不能证明达到终点,故A错误;
B、该反应为吸热反应,升高温度,平衡向正反应方向移动,则正反应平衡常数越大,逆反应平衡常数越小,故B错误;
C、反应2X(g)+Y(g)?Z(s)+3W(g)△H<0 是前后气体系数和相等的反应,压强不会引起平衡的移动,所以增加压强,正逆反应速率增加但是仍然相等,故C错误;
D、根据图象知,稀释相同的倍数,HA的pH变化快,所以HA的酸性比HB强,则相同浓度的钠盐溶液中,NaA溶液的pH小于同浓度的NaB溶液的pH,故D正确.
故选D.
点评 本题考化学平衡的影响因素、反应速率的影响因素以及盐的水解原理的应用知识,题目难度中等,注意盐类水解的分析判断,掌握基础是关键.


科目:高中化学 来源: 题型:解答题
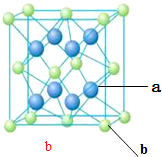 X、Y、Z、M、N、Q为元素周期表前四周期的六种主族元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.请回答下列问题:
X、Y、Z、M、N、Q为元素周期表前四周期的六种主族元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.请回答下列问题: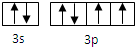 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向右移动 | B. | A的体积分数比原平衡时小 | ||
| C. | A的转化率增大 | D. | 正反应速率增大,逆反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
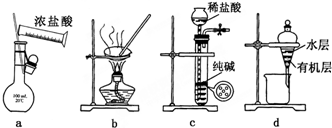
| A. | 用图a所示装置配制100mL0.100mol•L-1稀盐酸 | |
| B. | 用图b所示装置蒸干FeCl3饱和溶液制备FeCl3固体 | |
| C. | 用图c所示装置制取少量纯净的CO2气体 | |
| D. | 用图d所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | SO42-、NH4+和Na+ 一定存在,CO32-一定不存在 | |
| B. | SO42-、NH4+一定存在,Na+ 和CO32-一定不存在 | |
| C. | c(Fe3+)=0.1 mol•L-1 | |
| D. | c(Cl-)≥0.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO${\;}_{4}^{2-}$沉淀完全2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| B. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O═AlO2-+H2↑ | |
| C. | 玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-═Na2SiO3↓+H2O | |
| D. | VO2+与酸性高锰酸钾溶液反应:5VO2++MnO${\;}_{4}^{-}$+H2O═5VO${\;}_{2}^{+}$+Mn2++2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com