
| A、Cl2+2I-=2Cl-+I2 |
| B、Cl2+2Fe2+=2Fe3++2Cl- |
| C、Cl2+H2SO3+H2O═4H++SO42-+2Cl- |
| D、2FeI2+3Cl2=2FeCl3+2I2 |


科目:高中化学 来源: 题型:
A、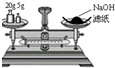 称量氢氧化钠固体 |
B、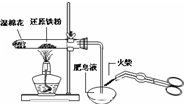 检验铁粉与水蒸气反应产生的氢气 |
C、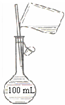 配制150 mL 0.10 mol/L盐酸 |
D、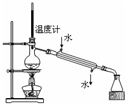 分离两种互溶但沸点相差较大的液体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热46.3kJ |
| ② | 0.8 | 2.4 | 0.4 | Q(Q>0) |
| A、容器①中达到平衡时,Y2的转化率为50% |
| B、Q=27.78kJ |
| C、若X2、Y2、XY3改按0、0、2投料,则达到平衡时吸热46.3KJ |
| D、若容器①体积改为1.0L.则达平衡时放出的热量小于46.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放热的反应在常温下一定易进行 |
| B、吸热反应在常温下不能进行 |
| C、有吸热或放热现象的过程中一定发生了化学反应 |
| D、反应是放热还是吸热是由反应物和生成物所具有的能量的相对大小决定的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、着色剂-----醋酸 |
| B、疏松剂-----碳酸氢钠 |
| C、调味剂------亚硝酸钠 |
| D、防腐剂------苯甲酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、亚硝酸盐是氧化剂 |
| B、维生素C是氧化剂 |
| C、亚硝酸盐将Fe3+还原成Fe2+ |
| D、维生素C被Fe3+氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,23g NO2 含有nA个氧原子 |
| B、0.1mol/L NaCl溶液含有0.1nA个Cl- |
| C、常温常压下,22.4L CCl4含有nA个CCl4分子 |
| D、含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com