
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法中正确的是
2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法中正确的是
①用物质 A 表示的反应的平均速率为 0.3 mol·L-1·S-1
②用物质 B 表示的反应的平均速率为 0.6 mol·L-1·S-1
③2 s 时物质 A 的转化率为70%
④2 s 时物质 B 的浓度为 0.7 mol·L-1,
A.①③ B.①④ C.②③ D.③④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)1.1中和反应反应热的测定(解析版) 题型:填空题
已知H+(aq)+OH-(aq) H2O(l) ΔH=-57.3 kJ·mol-1,回答下列问题。
H2O(l) ΔH=-57.3 kJ·mol-1,回答下列问题。
(1)用含20 g NaOH的稀溶液跟足量稀盐酸反应放出 kJ的热量。
(2)用含2 mol H2SO4的稀溶液跟足量稀NaOH反应,此反应的中和热的ΔH= 。
(3)如果将(1)反应中的稀盐酸换成稀醋酸,反应放出的热量 (填“大于”“小于”或“等于”)原来(1)放出的热量。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学铁及其化合物主要性质(解析版) 题型:选择题
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。
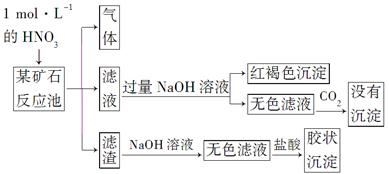
(1)Si在周期表中的位置是___________________________________。
(2)下列说法正确的是________。
a.酸性:H2CO3>H2SiO3
b.原子半径:O<C<Si<Al
c.稳定性:H2O>CH4>SiH4
d.离子半径:O2-<Al3+
(3)该矿石的组成是________,滤渣和NaOH溶液反应的离子方程式是_________________________________________________________。
(4)该矿石和1 mol·L-1HNO3反应的离子方程式为
___________________________________________________________。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中。目的是____________________________________;
若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 mol·L-1 HNO3的体积为________L。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学钠及其化合物主要性质(解析版) 题型:选择题
下列各组物质中,物质之间通过一步反应就能实现图示变化的是
物质编号 | 物质转化关系 | a | b | c | d |
① |
| FeCl2 | FeCl3 | Fe | CuCl2 |
② | NO | NO2 | N2 | HNO3 | |
③ | Na2O | Na2O2 | Na | NaOH | |
④ | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A.①④ B.①②③ C.①③④ D.②④
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学速率表示与平衡移动(解析版) 题型:选择题
对于反应CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
A.加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习5(解析版) 题型:填空题
如图是现今常规生产发烟硫酸和硫酸的流程图:
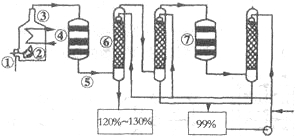
(1)在④处二氧化硫被氧化成三氧化硫,④的设备名称是 ,该处发生反应的方程式为 ,为提高三氧化硫的产率,该处应采用 (填“等温过程”或“绝热过程”)为宜。
(2)在⑦处进行二次催化处理的原因是 。
(3)⑤处气体混合物主要是氮气和三氧化硫.此时气体经过⑥后不立即进入⑦是因为 。
(4)20%的发烟硫酸(SO3的质量分数为20%)1吨需加水 吨(保留2位有效数字)才能配制成98%的成品硫酸。
(5)在②处发生1500℃的“不完全燃烧”,即先混入少量干燥空气,然后在③处于700℃下再继续燃烧.试简述这种燃烧方式对环境保护是有利的原因 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习5(解析版) 题型:填空题
2012年宾夕法尼亚大学研究人员展示了一种硒化镉纳米晶体,它能被“印”或“涂”在柔软塑料上,制成多种性能优良的电子设备。请回答下列问题:
(1)O、S、Se的电负性最小的是 ,它们的氢化物中沸点由高到低的顺序是 (用化学式表示)。
(2)硒的低价含氧酸盐—亚硒酸钠(Na2SeO3),能促进细胞DNA的增殖活性,延缓细胞衰老,SeO32-中的Se原子杂化方式是 ,空间构型为 ;
(3)镉(Cd)与锌为同族相邻元素,在周期表中Cd位于 区,Cd 的最外层电子排布图是 。
(4)锌单质晶体是六方最密堆积,原子按 (填“ABABAB”或“ABCABCABC”)的方式堆积而成,晶体中Zn原子的配位数为 ,锌易与某些小分子物质形成配合物,在[Zn(NH3)4]2+离子中提供孤电子对的原子是 (填元素符号)。
(5)镉和锌都是电的良导体,非金属晶体石墨也具有良好的导电性,下图为石墨晶体结构示意图及提供的资料,12g石墨晶体中正六边形的数目为 ,石墨的密度为 g·cm-3。(阿伏加德罗常数为NA)
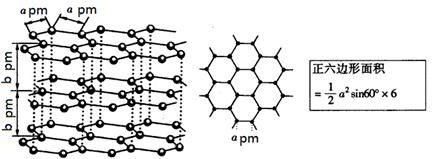
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习3(解析版) 题型:填空题
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收。请回答下列问题:
(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥后进入 (填设备名称),其主要目的是 。
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快 二氧化硫氧化速率,此过程中产生了一连串的中间体(如图1)
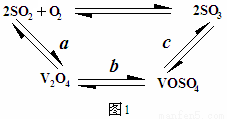
其中a、c二步反应的化学方程式可表示为: 、 。
(3)550℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(P)的关系如图2所示,
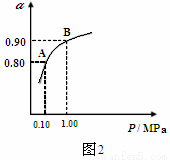
则:将2.0mol SO2和1.0mol O2置于5L密闭容器中,反应达平衡后,体系总压强为0.10M Pa,A与B表示不同压强下的SO2转化率,通常情况下工业生产中采用常压的原因是: 。
(4)为循环利用催化剂,科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣,查阅资料知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如图如下:

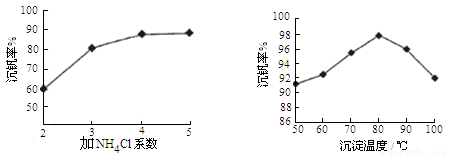
则反应①②③④中属于氧化还原反应的是 (填数字序号),反应①的离子方程式为 ,该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵系数和温度: 、 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子的性质及检验(解析版) 题型:选择题
某pH=1的工业废液,只可能含有以下离子中的若干种:H+、Mg2+、Ba2+、Cl-、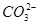 、
、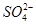 ,现取两份100 mL溶液进行如下实验:
,现取两份100 mL溶液进行如下实验:
第一份加入足量AgNO3溶液,得干燥沉淀3.50 g。
第二份加足量BaCl2溶液后,得干燥沉淀2.33 g,经足量盐酸洗涤、干燥后,沉淀质量不变。
根据上述实验,以下推测正确的是
①一定存在Mg2+;②可能存在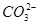 ;③一定存在Cl-;④可能存在Ba2+;⑤可能存在Mg2+
;③一定存在Cl-;④可能存在Ba2+;⑤可能存在Mg2+
A.①③ B.②③ C.③⑤ D.④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com