
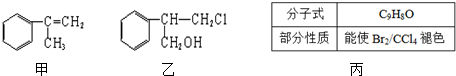

 +HCl$\stackrel{一定条件}{→}$
+HCl$\stackrel{一定条件}{→}$ (不需注明反应条件).
(不需注明反应条件).
 .
. 、
、 、
、 .
.分析 (1)由结构简式可知乙含有的官能团有羟基、氯原子;
(2)由甲转化为乙过程可知,反应II为NaOH水溶液条件下的水解生成Y为 ,反应III为
,反应III为 中的碳碳双键与HCl的加成反应得乙;
中的碳碳双键与HCl的加成反应得乙;
(3)甲和溴水发生加成反应生成A,A的结构简式为: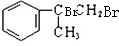 ,
,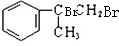 和氢氧化钠的水溶液发生取代反应生成B,B的结构简式为:
和氢氧化钠的水溶液发生取代反应生成B,B的结构简式为: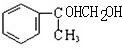 ,B被氧化生成C,则C的结构简式为:
,B被氧化生成C,则C的结构简式为: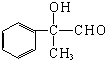 ,丙能使溴褪色,说明丙中含有碳碳双键,C发生消去反应生成丙,则丙的结构简式为:
,丙能使溴褪色,说明丙中含有碳碳双键,C发生消去反应生成丙,则丙的结构简式为: ,B发生消去反应生成D,D的结构简式为:
,B发生消去反应生成D,D的结构简式为: ,以此解答该题.
,以此解答该题.
解答 解:(1)由结构简式可知乙含有的官能团有羟基、氯原子,故答案为:羟基、氯原子;
(2)由甲转化为乙过程可知,反应II为NaOH水溶液、加热的条件下的水解生成Y为 ,反应III为
,反应III为 中的碳碳双键与HCl的加成反应得乙,反应方程式为
中的碳碳双键与HCl的加成反应得乙,反应方程式为 +HCl$\stackrel{一定条件}{→}$
+HCl$\stackrel{一定条件}{→}$ ,
,
故答案为:NaOH水溶液、加热; +HCl$\stackrel{一定条件}{→}$
+HCl$\stackrel{一定条件}{→}$ ;
;
(3)甲和溴水发生加成反应生成A,A的结构简式为: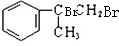 ,
,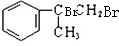 和氢氧化钠的水溶液发生取代反应生成B,B的结构简式为:
和氢氧化钠的水溶液发生取代反应生成B,B的结构简式为: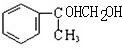 ,B被氧化生成C,则C的结构简式为:
,B被氧化生成C,则C的结构简式为: ,丙能使溴褪色,说明丙中含有碳碳双键,C发生消去反应生成丙,则丙的结构简式为
,丙能使溴褪色,说明丙中含有碳碳双键,C发生消去反应生成丙,则丙的结构简式为 ,B发生消去反应生成D,D的结构简式为
,B发生消去反应生成D,D的结构简式为 ,
,
( i)根据上面的分析可知,B的结构简式为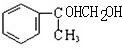 ,B能与钠或乙酸反应,但不能与溴水或碳酸钠反应,故选bd;
,B能与钠或乙酸反应,但不能与溴水或碳酸钠反应,故选bd;
(ii)根据上面的分析可知,丙的结构简式为 ,故答案为:
,故答案为: ;
;
(iii)D的结构简式为: ,D的结构简式符合下列条件:
,D的结构简式符合下列条件:
a.苯环上的一氯代物有两种说明苯环上含有两类氢原子;
b.遇FeCl3溶液发生显色反应说明含有酚羟基;
c.能与Br2/CCl4发生加成反应说明含有碳碳不饱和键,
则符合条件的D的同分异构体有: 、
、 、
、 ,所以有3种同分异构体,
,所以有3种同分异构体,
故答案为: 、
、 、
、 .
.
点评 本题考查了有机物的推断,根据有机物的结构、官能团及其性质结合反应条件来分析解答,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验项目 | 实验现象 |
| FeCl3溶液中加入维生素C(Vc) | 溶液褪为浅绿色 |
| Fe(OH)3胶体通直流电 | 阴极附近红褐色加深 |
| 将铜锈放入盐酸中 | 有无色气泡产生 |
| A. | 维生素C(Vc)具有还原性 | B. | Fe(OH)3胶体粒子带正电荷 | ||
| C. | 铜锈与盐酸反应一定有CO2生成 | D. | 铜锈中可能含有碳酸根 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 )下列有关联苯的说法中正确的是( )
)下列有关联苯的说法中正确的是( )| A. | 分子中含有6个碳碳双键 | |
| B. | 1mol联苯最多可以和6molH2发生加成反应 | |
| C. | 它可以发生加成反应、取代反应,不易被酸性高锰酸钾氧化 | |
| D. | 它和蒽( )同属于芳香烃,两者互为同系物 )同属于芳香烃,两者互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 化学式 | N2 | O2 | CO2 | NH3 | Cl2 |
| 熔点(℃) | -209.86 | -218.4 | -78.5 | -77.3 | -101 |
| 沸点(℃) | -195.8 | -183 | -33.35 | -34.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com