
| 装置图 | 所盛试剂 | 实验现象 | |
| 1 | 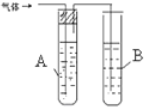 | A是 水 B是 酸性高锰酸钾溶液 | |
| 2 |  | C是 溴的四氯化碳溶液 |
分析 1-氯丙烷发生消去反应生成丙烯,故需要检验的是有丙烯生成;
方案1:丙烯能够使酸性高锰酸钾褪色;
方案2:丙烯能够使溴的四氯化碳溶液褪色.
解答 解:1-氯丙烷发生消去反应生成丙烯,故需要检验的是有丙烯生成;
方案1:丙烯能够使酸性高锰酸钾褪色,
方法是:将生成的气体先通过盛有水的试管,除掉乙醇,再通入盛有酸性KMnO4溶液的试管,酸性KMnO4溶液褪色;
方案2:丙烯能够使溴的四氯化碳溶液褪色,
方法是:将生成的气体直接通入盛有溴的四氯化碳溶液的试管,溴的四氯化碳溶液褪色;
故答案为:水、酸性高锰酸钾溶液、A处有气泡产生,B处溶液褪色,溴的四氯化碳溶液,C处溶液褪色.
点评 本题考查卤代烃的性质、反应原理的探究、实验方案的设计等,难度较大,要注重学生分析和解决问题能力的培养.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:解答题
 A、B、C、D、E均为中学化学中的常见物质,它们之间的反应关系如图所示:
A、B、C、D、E均为中学化学中的常见物质,它们之间的反应关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | CH3-CH2-CH2-CH2-OH | ||
| C. | CH2=CHCl | D. | 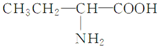 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④③ | B. | ⑤④③ | C. | ②①③ | D. | ②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳分子中存在共价键和分子间作用力 | |
| B. | 甲烷、氨和双氧水都是只由极性键结合而成的分子 | |
| C. | 同主族不同元素的最高价氧化物的水化物从上到下酸性递增 | |
| D. | 氟化氢的沸点高于氯化氢的沸点,水的沸点高于硫化氢的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 HClO+OH-
HClO+OH-查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com