
已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是
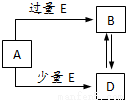
A、若A是铁,则E可能为稀硝酸
B、若A是CuO,E是碳,则B为CO
C、若A是AlCl3溶液,E可能是氨水
D、若A是NaOH溶液,E是CO2,则B为NaHCO3
科目:高中化学 来源:2017届湖南省高三上月考三化学试卷(解析版) 题型:选择题
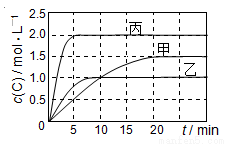
向甲乙丙三个容器中充入一定量的A和B,发生反应:A(g)+xB(g) 2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
容器 | 甲 | 乙 | 丙 |
容积 | 0.5L | 0.5L | 1.0L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 15.molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
下列说法正确的是
A.10min内甲容器中反应的平均速率v(A)=0.025mol/(L•min)
B.由图可知:T1<T2,且该反应为吸热反应
C.若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上期中化学试卷(解析版) 题型:实验题
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
利用下图所示装置进行实验。
(1)装置①的作用是 装置③的作用是 。
(2)装置②中产生ClO2的化学方程式为 。装置④中产生NaClO2的化学方程式为 。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用c mol•L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
(4)滴定中使用的指示剂是 。
(5)样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上期中化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.无色透明的溶液: H+、Al 3+、NH4+、NO3-、
3+、NH4+、NO3-、 K+
K+
B.FeCl3溶液中:K+、Na+、SCN-、Cl-
C.能使淀粉KI试纸显蓝色的溶液中:K+、SO42-、S2-、SO32-
D.含有0.1 mol·L-1 HCO3-的溶液:Na+、 Fe3+、NO3-、SO42-
Fe3+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源:2017届湖南省高三上月考二化学试卷(解析版) 题型:选择题
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是
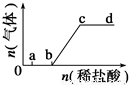
A.a点对应的溶液中:Na+、OH-、SO42-、NO3-
B.c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
C.b点对应的溶液中:Al3+、Fe3+、NO3-、Cl-
D.d点对应的溶液中:Fe2+、Na+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源:2017届湖南省高三上月考二化学试卷(解析版) 题型:选择题
有10g Na2O2、Na2O、Na2CO3、NaOH的混合物与100g质量分数为3.65%的盐酸恰好反应,蒸干溶液,最终得固体质量为
A.11.7g B.5.85g C.8g D.15.5g
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江牡丹江高级中学高三上期中化学卷(解析版) 题型:填空题
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4—(绿色)、Cr2O72—(橙红色)、CrO42—(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答:
(1)Cr3+与Al3+的化学性质相似,往Cr2(SO4)3溶液中滴入NaOH溶液直至过量,可观察到的现象是 。
(2)CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0mol•L﹣1的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示。
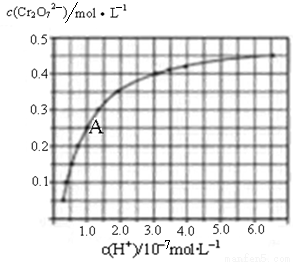
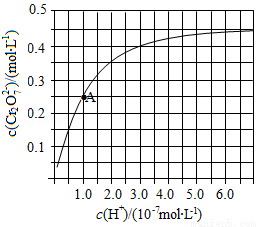 ①用离子方程式表示Na2CrO4溶液中的转化反应 。
①用离子方程式表示Na2CrO4溶液中的转化反应 。
②由图可知,溶液酸性增强,CrO42﹣的平衡转化率 (填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为 。
(3)用K2CrO4为指示剂,以AgNO3标准液滴定溶液中的Cl﹣,Ag+与CrO42﹣生成砖红色沉淀时到达滴定终点。当溶液中Cl﹣恰好完全沉淀(浓度等于1.0×10﹣5mol•L﹣1)时,溶液中c (Ag+)为 mol•L﹣1,此时溶液中c(CrO42﹣)等于 mol•L﹣1。(Ksp(Ag2CrO4)=2.0×10﹣12、Ksp(AgCl)=2.0×10﹣10)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72﹣还原成Cr3+,反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江牡丹江高级中学高三上期中化学卷(解析版) 题型:选择题
密闭容器中, xA(
 g)+yB(g)
g)+yB(g) zC(g)达平衡时A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,A的浓度为0.30mol/L。下列说法正确的是
zC(g)达平衡时A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,A的浓度为0.30mol/L。下列说法正确的是
A.平衡向正反应方向移动 B.x+y<z
C.B的转化率升高 D.C的体积分数下降
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期11月月考化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W、Q的原子序数依次增大,且只有一种金属元素,其中X与W处于同一主族,Z元素的原子半径在短周期中最大(稀有气体除外),W、Z之间与W、Q之间原子序数之差相等,五种元素原子最外层电子数之和为21。下列说法正确的是
A. Y的简单离子半径小于Z的简单离子半径
B. Z的最高价氧化物对应水化物分别与X、Y的最高价氧化物对应水化物反应生成1mol水时所放出的热量相同
C. Y的简单气态氢化物在一定条件下可被Q单质氧化
D. Q可分别与X、Y、Z、W形成化学键类型相同的化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com