
【题目】取一定量硫酸亚铁和硫酸铁混合物样品溶于水,配成100mL溶液。所得溶液分成二份,在第一份溶液中加入0.5mol·L-1氯化钡220mL恰好完全反应;在第二份溶液中通入标准状况下的氯气0.896L,可使Fe2+全部变成Fe3+。
(1)所取样品中硫酸亚铁物质的量是___。
(2)在第一份溶液完全反应后的溶液中再加入足量氢氧化钠溶液,所得沉淀经洗涤后,在空气中充分灼烧,得到残渣的质量是___。
【答案】0.16mol 8g
【解析】
(1) 第二份溶液中通入标准状况下的氯气0.896L,发生反应2Fe2++Cl2=2Fe3++2Cl-,以此计算亚铁离子的物质的量;
(2) 加入氯化钡溶液,发生反应:Ba2++![]() -=BaSO4↓,用钡离子的物质的量计算第一份溶液中的硫酸根离子的物质的量,进而求得物质硫酸铁的物质的量,加入NaOH溶液后,在空气中充分灼烧,得到的残渣为Fe2O3,由铁原子守恒求得质量。
-=BaSO4↓,用钡离子的物质的量计算第一份溶液中的硫酸根离子的物质的量,进而求得物质硫酸铁的物质的量,加入NaOH溶液后,在空气中充分灼烧,得到的残渣为Fe2O3,由铁原子守恒求得质量。
(1)在第二份溶液中通入标准状况下的氯气0.896L,发生反应2Fe2++Cl2=2Fe3++2Cl-,![]() ,因所取样品配成溶液分成二份,则样品中硫酸亚铁物质的量是
,因所取样品配成溶液分成二份,则样品中硫酸亚铁物质的量是![]() ,故答案为0.16mol;
,故答案为0.16mol;
(2)在第一份溶液中加入0.5molLˉ1氯化钡溶液220mL,发生反应:Ba2++![]() -=BaSO4↓,
-=BaSO4↓,![]() ,则Fe2(SO4)3中的n(
,则Fe2(SO4)3中的n(![]() )=0.11mol-0.08mol=0.03mol,
)=0.11mol-0.08mol=0.03mol,![]() ,
,![]() ,每份溶液中含有Fe2+和Fe3+的物质的量分别为0.08mol和0.02mol,在第一份溶液完全反应后所得溶液中再加入足量氢氧化钠溶液,所得沉淀经洗涤,在空气中充分灼烧,得到的残渣为Fe2O3,根据铁原子守恒可知:
,每份溶液中含有Fe2+和Fe3+的物质的量分别为0.08mol和0.02mol,在第一份溶液完全反应后所得溶液中再加入足量氢氧化钠溶液,所得沉淀经洗涤,在空气中充分灼烧,得到的残渣为Fe2O3,根据铁原子守恒可知:![]() ,
,![]() ,故答案为8g。
,故答案为8g。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 氢原子的电子云图中小黑点的疏密表示电子在核外单位体积内出现机会的多少
B. 最外层电子数为ns2的元素都在元素周期表第2列
C. 处于最低能量的原子叫做基态原子,1s22s22![]() →1s22s22
→1s22s22![]() 过程中形成的是发射光谱
过程中形成的是发射光谱
D. 已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素位于周期表中的第四周期第VIII族位置,属于ds区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。
完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
已知H2的体积分数随温度升高而增加。
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/mol·L-1 | [H2]/mol·L-1 | [CH4]/mol·L-1 | [H2O]/mol·L-1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为_________。
(3)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”)
等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。
若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____。(选填编号)
a.[H+]>[HC2O4-]>[HCO3-]>[CO32-]
B.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
c.[H+]>[HC2O4-]>[C2O42-]>[CO32-]
D.[H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
(4)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3-![]() H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。
H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。
____________________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K2Cr2O7溶液中存在平衡:Cr2O72-+H2O ![]() 2CrO42-+2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
2CrO42-+2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
| 序号 | 试剂X |
ⅰ | 1 mL1mol·L-1 K2Cr2O7 溶液 | |
ⅱ | 1mL1 mol·L-1 K2CrO4溶液 | |
ⅲ | 5~15滴浓硫酸 | |
ⅳ | 5~15滴浓盐酸 | |
ⅴ | 5~15滴6 mol·L-1 NaOH溶液 |
Ⅰ.方案讨论
(1)ⅰ~ⅴ中依据减少生成物浓度可导致平衡移动的原理设计的是______(填序号)。
(2)已知BaCrO4为黄色沉淀。某同学认为试剂X还可设计为Ba(NO3)2溶液,加入该试剂后,溶液颜色将_____。(填“变深”、“变浅”或“不变”)。
Ⅱ.实验分析
序号 | 试剂X | 预期现象 | 实际现象 |
ⅰ | 1 mL1 mol·L-1 K2Cr2O7 溶液 | 溶液变黄 | 溶液橙色加深 |
ⅱ | 1mL1 mol·L-1 K2CrO4溶液 | 溶液橙色加深 | 溶液颜色变浅 |
ⅲ | 5~15滴浓硫酸 | 溶液橙色加深 | 溶液橙色加深 |
ⅳ | 5~15滴浓盐酸 | 溶液橙色加深 | 无明显现象 |
ⅴ | 5~15滴6mol·L-1NaOH溶液 | 溶液变黄 | 溶液变黄 |
(1)实验ⅰ没有观察到预期现象的原因是____________,实验ⅱ的原因与其相似。
(2)通过实验ⅲ和ⅴ得出的结论为___________ 。
(3)实验ⅳ无明显现象,可能的原因是____________。
(4)某同学查阅资料发现:K2Cr2O7溶液与浓盐酸可发生氧化还原反应。但实验ⅳ中没有观察到明显现象,小组同学设计了两个实验,验证了该反应的发生。
① 方案一:取5 mL浓盐酸,向其中加入15滴0.1mol·L-1 K2Cr2O7溶液,一段时间后,溶液变为绿色(CrCl3水溶液呈绿色),有黄绿色气体生成。写出该变化的化学方程式__________。
② 请你设计方案二:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜镁合金1.52g完全溶解于50mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B.得到2.54g沉淀时,加入NaOH溶液的体积是600mL
C.该浓硝酸中HNO3的物质的量浓度是14.0mol·L-1
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
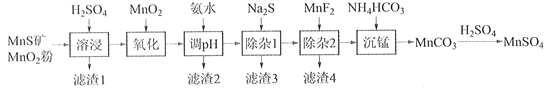
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnz2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___________。
时,z=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作不能达到目的的是( )

A. 装置①:制取乙炔并验证炔烃的性质B. 装置②:检验乙醇的还原性,溶液颜色从橙色变成绿色
C. 装置③:验证葡萄糖分子中含有醛基官能团D. 装置④:酸性KMnO4溶液中出现气泡且颜色逐渐褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A仅含有C、H、O三种元素,可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
限选试剂:蒸馏水、2 mol·L-1盐酸溶液、2 mol·L-1NaOH溶液、浓硫酸、NaHCO3粉末、金属Na、无水乙醇
实验步骤 | 实验结论 |
(1)A的质谱图如下: | (1)证明A的相对分子质量为:__________。 |
(2)将此9.0 g A在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4 g和13.2 g。 | (2)证明A的分子式为: ________________。 |
(3)另取两份9.0 g A分置于不同的试管中。往其中一份A中加入足量的NaHCO3粉末充分反应,生成_______ L CO2(标准状况)。 往另一份A中加入足量的金属钠充分反应,生成________________________ L H2(标准状况)。 | (3)证明A的分子中含有一个羧基和一个羟基。 |
(4)A的核磁共振氢谱如下图: | (4)A的结构简式为: __________________。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A.稀硫酸有酸性,可用于除去铁锈
B.Al2O3具有两性,可用于电解冶炼铝
C.SO2能使酸性高锰酸钾溶液褪色,可用于漂白有色物质
D.甲醛溶液能使蛋白质发生变性,可用于动物标本的防腐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com