
【题目】将一定质量Na2CO3和NaHCO3的均匀混合物分成等量的两份.将其中的一份直接加热至恒重,质量减轻了1.24g;另一份加入一定;量某浓度的盐酸至恰好反应完全,收集到标准状况下2.24L气体,消耗盐酸40.0mL.试计算:
(1)原均匀混合物中NaHCO3的物质的量.n(NaHCO3)=mol.
(2)盐酸的浓度c(HCl)=mol/L.
【答案】
(1)0.08
(2)4
【解析】解:(1)固体加热时发生
2NaHCO3 |
| Na2CO3+ | CO2↑+ | H2O | △m |
168g | 62g | ||||
x | 1.24g |
x= ![]() =3.36g,n(NaHCO3)=
=3.36g,n(NaHCO3)= ![]() =0.04mol,
=0.04mol,
原均匀混合物中NaHCO3的物质的量.n(NaHCO3)=0.08mol,所以答案是:0.08mol;(2)收集到标准状况下2.24L气体,所以一份中碳酸钠和碳酸氢钠的物质的量之和为0.1mol,所以碳酸钠的物质的量为0.06mol,与一定量某浓度的盐酸至恰好反应完全,生成氯化钠,所以盐酸的物质的量为:0.04+0.06×2=0.16mol,所以盐酸的浓度c(HCl)=4.00mol/L,所以答案是:4.


科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A.CS2为V形的极性分子
B.ClO3﹣ 的空间构型为平面三角形
C.SF6中有6对完全相同的成键电子对
D.SiF4和SO32﹣ 的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 含有离子键的化合物一定是离子化合物
B. 阳离子一定由金属元素组成
C. 离子化合物中一定含有金属元素
D. 非金属元素所组成的化合物中不可能含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)如图所示,在一个小烧杯里加入研细的20g Ba(OH)28H2O晶体.将此小烧杯放在事先滴有3~4滴水的玻璃片上,然后向小烧杯中加入10g NH4Cl晶体,并用玻璃棒快速搅拌. 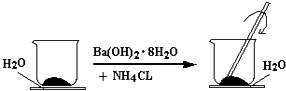
①实验中玻璃棒作用是;
②写出有关反应的化学方程式:;
从四大基本反应类型分析,该反应类型是;
③实验现象可以说明该反应的反应物的总能量(填“大于”或“小于”)生成物的总能量
(2)氢气是未来最理想的能源之一,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O ![]() 2H2↑+O2↑.制得的氢气可用于燃料电池. 试回答下列问题:
2H2↑+O2↑.制得的氢气可用于燃料电池. 试回答下列问题:
①海水分解生成的氢气用于燃料电池时,实现能转变为能.水分解时,断裂的化学键为键,分解海水的反应属于反应(填“放热”或“吸热”).
②某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:A极:2H2+2O2﹣﹣4e﹣═2H2O;B极:O2+4e﹣═2O2﹣ , 则A极是电池的极;电子从该极(填“流入”或“流出”).
③有人以化学反应:2Zn+O2+4H+═2Zn2++2H2O为基础设计出一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作.则原电池的负极上发生反应的电极反应式为 .
(3)若氢气的燃烧过程中,破坏1molH2中的化学键消耗的能量为Q1kJ,破坏1molO2中的化学键为Q2kJ,形成1molH2O中的化学键释放的能量为Q3 . 下列关系式正确的是
A.Q1+Q2>Q3
B.Q1+Q2<Q3
C.2Q1+Q2>2Q3
D.2Q1+Q2<2Q3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或者污染很小,且可以再生.下列属于未来新能源标准的是( )
①天然气 ②生物质能 ③潮汐能 ④石油 ⑤太阳能 ⑥煤 ⑦风能 ⑧氢能.
A.①②③④
B.②③⑤⑦⑧
C.⑤⑥⑦⑧
D.③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造地球卫星用到的一种高能电池﹣﹣银锌蓄电池,其电池的电极反应式为:Zn+2OH﹣﹣2e﹣═ZnO+H2↑,Ag2O+H2O+2e﹣═2Ag+2OH﹣ . 据此判断氧化银是( )
A.负极,被氧化
B.正极,被还原
C.负极,被还原
D.正极,被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】做罐头的马口铁是在铁的表面上镀上一层既耐腐蚀有无毒的锡,但食用时开启后的罐头易生锈,其所发生的反应正确的是( )
A.负极Sn﹣2e→Sn2+
B.正极Fe﹣2e→Fe2+
C.正极2H2O+O2﹣2e→4OH﹣
D.负极Fe﹣2e→Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X,Y,Z三种气体的物质的量随时间变化的曲线如图所示,下列表述中正确的是( ) 
A.反应的化学方程式为2X=3Y+Z
B.t时,正、逆反应都不再继续进行,反应达到化学平衡
C.若t=4,则0~t的X的化学反应速率为0.1 molL﹣1min﹣1
D.温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2气体在一定条件下可与金属镁反应,干冰在一定条件下也可以形成CO2气体,这两个变化过程中需要克服的作用分别是
A.化学键,化学键 B. 化学键,分子间作用力
C.分子间作用力,化学键 D. 分子间作用力,分子间作用力
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com