
| A. | ④>①>③>② | B. | ④=①>③>② | C. | ①>④>③>② | D. | ①=④>③=② |
分析 先根据n=CV计算溶质的物质的量,再根据溶质的电离和水解分析带电微粒的多少.
解答 解:等体积,等物质的量浓度的4种稀溶液,根据n=CV知,各溶质的物质的量相等.
H2SO4、NaHSO3、Na2CO3是强电解质,在水中完全电离;H2SO4、Na2CO3中阳离子和阴离子个数比为2:1,NaHSO3中阳离子和阴离子个数比为1:1,所以碳酸钠和硫酸的溶液中阴阳离子数大于亚硫酸氢钠溶液中的阴阳离子数;硫酸是强酸,完全电离,Na2CO3是强碱弱酸盐,在水中水解导致溶液中带电荷的微粒数增多,所以Na2CO3溶液中的带电微粒数大于硫酸溶液中的带电微粒数;亚硫酸是弱电解质,只有部分电离,所以亚硫酸溶液中带电微粒数最少,所以:①H2SO4 ②H2SO3 ③NaHSO3 ④Na2CO3中含带电微粒数由多到少的顺序是④>①>③>②.
故选A.
点评 本题考查了溶液中带电微粒多少的判断,题目难度中等,注意:强酸弱碱盐或强碱弱酸在水中以电离为主,水解是微弱的.


科目:高中化学 来源: 题型:选择题
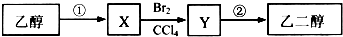
| A. | 步骤①的反应类型是氧化反应 | |
| B. | 等物质的量的乙醇、乙二醇完全燃烧,消耗氧气的量相同 | |
| C. | 1 mol乙二醇与乙酸若完全发生酯化反应,理论上可以增重120g | |
| D. | X可以使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
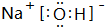 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳-14核素:${\;}_8^{14}C$ | B. | Ca2+的结构示意图为  | ||
| C. | 氮气的电子式 | D. | HCIO的结构式为H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
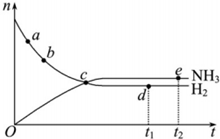 对于体积不变密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
对于体积不变密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | a点、b点的正反应速率比逆反应速率大 | |
| B. | c点时每断裂3molH-H则断裂6molN-H | |
| C. | d点(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | v(N2):V (NH3)=1:2时达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液与少量氢氧化钙溶液混合:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 用石墨做电极电解硫酸铜溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 向FeBr2溶液中通入等量的Cl2:2Br-+2Fe2++2Cl2═Br2+2Fe3++4Cl- | |
| D. | 向硫酸铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
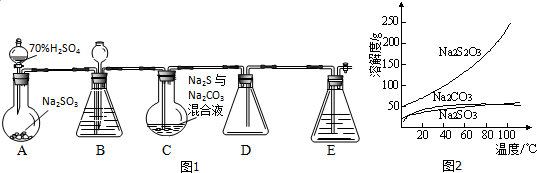
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com