
【题目】25℃时,向1L c(HA)+c(A-)=0.1mol/L的溶液中滴加盐酸或NaOH溶液,溶液中的H+、OH-、A-及HA的浓度的对数值(lgc)与pH的关系如图所示(不考虑溶液温度变化),下列说法正确的是

A.a表示lgc(A-)与pH的关系曲线
B.K(HA)的数量级为10-5
C.P点溶液中n(Na+)+ n(H+)=0.1mol
D.滴加盐酸或NaOH溶液的过程中c(HA)·c(OH-)均增大
【答案】BC
【解析】
根据图像分析,微粒浓度的对数越大离子浓度越大,随着pH的增大,溶液碱性增强,酸性减弱,则氢离子浓度逐渐减小,氢氧根离子浓度逐渐增大;c的浓度对数值在减小,为c(H+)浓度变化曲线;d的浓度对数值在增大,为c(OH-)浓度变化曲线;pH小于4.75时,a的浓度对数值不变,pH越大,a的浓度对数值减小,应该是c(HA)的变化曲线;b的浓度对数值随pH的增大而增大,b为c(A-)变化曲线;
A. 根据上述分析a表示lg c(HA)与pH的关系曲线,故A错误;
B.K(HA)的表达式为K(HA)= ,pH=4.75时,c(HA)=c(A-),K(HA)=
,pH=4.75时,c(HA)=c(A-),K(HA)= =10-4.75≈1.78×10-5,数量级为10-5,故B正确;
=10-4.75≈1.78×10-5,数量级为10-5,故B正确;
C.P点时,c(OH-)=c(HA),P点的电荷守恒式为c(H+)+ c(Na+)= c(A-) +c(OH-),变式为 c(H+)+ c(Na+)=c(A-)+c(HA),根据题中信息,1Lc(HA)+c(A-)=0.1mol/L的溶液中,n(HA)+n(A-)=0.1mol/L×1L=0.1mol,则溶液中n(Na+)+ n(H+)=0.1mol,故C正确;
D. 滴加盐酸或NaOH溶液的过程中,K(HA)=  ,c(H+)=
,c(H+)=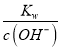 , K(HA)=
, K(HA)= ,K(HA)、Kw只受温度影响,温度不变,平衡常数不变,滴加盐酸,c(A-)在减小,c(OH-)c(HA)在减小,故D错误;
,K(HA)、Kw只受温度影响,温度不变,平衡常数不变,滴加盐酸,c(A-)在减小,c(OH-)c(HA)在减小,故D错误;
答案选BC。


科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的认识不正确的是( )
A.乙醇与乙酸在一定条件下可发生酯化反应
B.四氯化碳为有机非极性溶剂
C.在水溶液里,乙酸分子中的—CH3可以电离出H+
D.在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电絮凝的反应原理是以铝、铁等金属为阳极,在直流电的作用下,阳极被溶蚀,产生金属离子,在经一系列水解、聚合及氧化过程,发展成为各种羟基络合物、多核羟基络合物以及氢氧化物,使废水中的胶态杂质、悬浮杂质凝聚沉淀而分离。下列说法不正确的是

A.每产生1molO2,整个电解池中理论上转移电子数为4NA
B.阴极电极反应式为2H2O + 2e- = H2↑+2OH—
C.若铁为阳极,则阳极电极方程式为Fe-2e-=Fe2+和2H2O - 4e- = O2↑+4H+
D.若铁为阳极,则在处理废水的过程中阳极附近会发生:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,,有关物质X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )
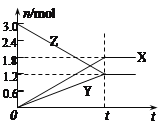
A. 该反应的化学方程式为: 3Z = 3X+2Y
B. t0时,X、Y、Z的质量不再改变
C. t0时,Z的浓度为1.2 mol/L
D. t0时,反应停止,反应速率为0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在建国70周年阅兵仪式上,“歼20”“东风—41核导弹”等国之重器亮相,它们采用了大量合金材料。回答下列问题:
(1)早期战斗机主要采用铝合金,其中超硬铝属Al—Cu—Mg—Zn系。Cu在元素周期表中的位置是___,比较第一电离能Mg___Al(填“>”“<”“=”)。
(2)金属Zn中的原子采取___最密堆积。
(3)中期战斗机主要采用钛合金,Ti的价电子排布图为___。钛晶体在882℃以上为体心立方的β钛,其中钛原子的配位数为___。
(4)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成Ti(SO4)2、NiSO4,其中阴离子的立体构型为___,S的___杂化轨道与O的2p轨道形成___键(填“π”或“σ”)。
(5)隐形战机采用Fe(CO)5(羰基铁)作为吸波材料,羰基铁在常温下为红棕色液体,固体羰基铁属于___晶体,CO与Fe之间的化学键称为___。与CO互为等电子体的分子或离子是___(只写一种)。
(6)一种钛镍合金的立方晶胞结构如图所示,若晶胞的边长为apm,则晶胞的密度为___g/cm3(用含a、NA的计算式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下对甲基苯甲醚为无色液体,具有紫罗兰的香气,可由对甲基苯酚与甲醇在浓硫酸催化作用下制取,反应装置(部分夹持装置已略去)如图所示:

制备反应为![]() +CH3OH
+CH3OH![]()
![]() +H2O。可能用到的数据如下:
+H2O。可能用到的数据如下:
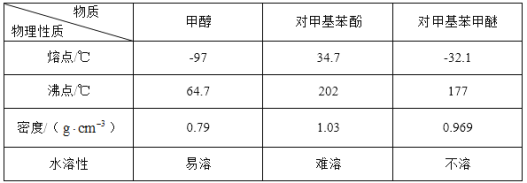
Ⅰ.合成反应:在图1的烧瓶中先加入几片碎瓷片,再依次加入10.8g对甲基苯酚、10mL甲醇,最后加入2mL浓硫酸,控制反应温度为60℃(水浴加热)进行反应。
Ⅱ.产物提纯:①将反应混合液冷却后加入足量饱和碳酸钠溶液,充分反应后转移至分液漏斗中,静置分液;②将有机层转移至图2烧瓶中,加热,控制温度为100℃进行蒸馏,待蒸馏结束后,向烧瓶内剩余液体中加入足量无水氯化钙,然后趁热过滤,并将所得液体再次进行蒸馏,收集177℃左右馏分,蒸馏结束后,称量所得馏分为7.32g。
回答下列问题:
(1)仪器A的名称为__。
(2)向图1的烧瓶中加入碎瓷片的目的是__;采用水浴加热的目的是__。
(3)产物提纯时,向反应混合液中加入足量饱和碳酸钠溶液的作用是__;产物提纯时,先控制温度为100℃进行蒸馏的目的是__。
(4)加入足量无水氯化钙的目的是__。
(5)收集到的177℃左右的馏分主要是__(填名称)。
(6)对甲基苯甲醚的产率为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“臭苏打”是硫化钠的俗名,又称臭碱,黄碱,硫化碱,具有臭味,硫化钠溶解于冷水,极易溶于热水,微溶于醇,是重要的化工产品。
(1)硫化钠水溶液具有臭味是S2-水解产生H2S造成的,用离子方程式解释_____________。
(2)Na2S具有较强的还原性,其水溶液在空气中会缓慢地氧化成硫代硫酸钠,写出化学方程式__________________________________。
(3)某学习小组设计实验探究金属硫化物的性质。
Ⅰ.探究Na2S的还原性
甲同学取少量硫化钠溶液于试管,滴加2滴酚酞溶液,再滴加溴水溶液,观察到溶液颜色变浅。
①酚酞的作用是____________;写出该实验的离子方程式____________________
②乙同学认为甲方案不严密。他设计方案:取少量硫化钠溶液于试管,滴加适量苯,再用长滴管加入溴水。加入“苯”的目的是_________________________
Ⅱ.探究氧化还原反应和沉淀反应的竞争
丙同学设计以下两组实验:
实验1、①在10 mL 2 mol·L-1FeCl3溶液中滴加2 mL 1 mol·L-1Na2S溶液,观察到有浅黄色沉淀生成,溶液黄色变浅。
②在10mL 2 mol·L-1Na2S溶液中滴加2mL1 mol·L-1FeCl3溶液。观察到先产生浅黄色固体,随后生成黑色固体,溶液黄色变无色。
实验2、在2 mol·L-1Na2S溶液中滴加少量AgNO3溶液,立即产生大量黑色沉淀,没有浅黄色沉淀。
实验1 中产生的浅黄色固体是_______(填化学式)。写出实验1 ②中产生黑色沉淀的离子方程式_____________;已知:氧化性有Ag+>Fe3+,实验2中,发生复分解反应,未发生氧化还原反应。
实验结论:若某一溶液中同时存在氧化还原反应和沉淀反应,则_________(填“氧化还原”或“生成更难溶物质”)反应将优先进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,Na2O2只表现强氧化性的是
A. 2Na2O2 + 2CO22Na2CO3 + O2
B. Na2O2 + MnO2 =Na2MnO4
C. 5Na2O2 + 2MnO![]() + 16H+ = 10Na+ + 2Mn2+ + 5O2↑ + 8H2O
+ 16H+ = 10Na+ + 2Mn2+ + 5O2↑ + 8H2O
D. 2Na2O2 + 2H2SO4 = 2Na2SO4 +2H2O + O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com