
| Fe3O4 | Fe2O3 | Fe | |
| 分解温度/°C | 1538 | 1400 | - |
| 熔点/°C | - | - | 1535 |
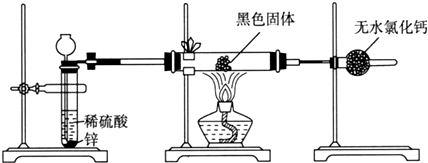
分析 (1)根据Fe的熔点及两种氧化物的分解温度确定黑色物质的成分;
(2)根据反应前后黑色固体与硬质玻璃管总质量的差值即为Fe与O2反应消耗O2的质量来判断;
(3)当铁元素恰好完全沉淀时,溶液中剩余的溶质为NaCl,据此化学式可知n(Na+)=n(Cl-)=n(NaOH)=n(HCl),据此计算.
解答 解:(1)根据Fe的熔点及两种氧化物的分解温度可知Fe熔化的温度下,Fe2O3已分解,不可能存在于黑色物质中.验证黑色物质中是否存在Fe应利用Fe与Fe3O4的不同,酸液中,Fe3O4会生成Fe3+,将可能存在的Fe氧化为Fe2+,不放出气体,而Fe与Fe3O4 都有磁性,都能被磁铁吸引,Fe3O4也具有磁性,能被磁铁吸引,方案3不可取.故答案为:Fe和Fe3O4;黑色固体中Fe含量很少,同时在溶液中发生反应:2Fe3++Fe=3Fe2+,则方案1看不到明显现象;
(2)反应前后黑色固体与硬质玻璃管总质量的差值即为Fe与O2反应消耗O2的质量,为:m1-m2,根据反,3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4,从而可以求出原黑色固体中Fe3O4的质量是$\frac{29(m1-m2)}{8}$g,质量分数是$\frac{29(m1-m2)}{8(m2-m3)}$×100%=,故答案为:②③⑤;$\frac{29(m1-m2)}{8(m2-m3)}$;
(3)当铁元素恰好完全沉淀时,溶液中剩余的溶质为NaCl,据此化学式可知n(Na+)=n(Cl-)=n(NaOH)=n(HCl),即0.1 L×1.5 mol/L=1 mol/L×V(NaOH),解得:V(NaOH)=0.15 L.故选C.
点评 本题是一道关于铁元素以及化合物性质实验方案设计的考查题,注意知识的归纳和梳理是关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | CuSO4 | B. | NaOH | C. | H2SO4 | D. | HC1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .FeCl3是共价化合物(填“离子”或“共价”).
.FeCl3是共价化合物(填“离子”或“共价”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
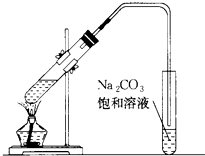 图是实验室制乙酸乙酯的装置.
图是实验室制乙酸乙酯的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
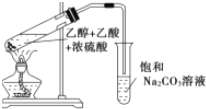 实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象.
实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象. )溶于乙醇中并不是简单的物理溶解而是伴随着化学反应,生成了硫酸乙酯(
)溶于乙醇中并不是简单的物理溶解而是伴随着化学反应,生成了硫酸乙酯(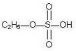 )和硫酸二乙酯(
)和硫酸二乙酯(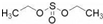 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
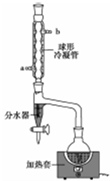 乙酸正丁酯是一种水果香味的无色透明液体,常用于调制香料和药物.实验室用正丁醇和乙酸制备,反应原理如下:
乙酸正丁酯是一种水果香味的无色透明液体,常用于调制香料和药物.实验室用正丁醇和乙酸制备,反应原理如下:| 物质名称 | 沸点/℃ | 熔点/℃ | 密度/g•cm-3 | 水中溶解度 |
| 正丁醇 | 117.3 | -89.5 | 0.80 | 7.1g/100g |
| 乙酸 | 118 | 16.6 | 1.0492 | 互溶 |
| 乙酸正丁酯 | 126.1 | -78 | 0.8826 | 1.4g/100g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
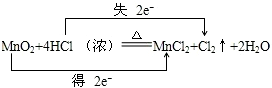 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com