
| A. | 2Na+O2$\frac{\underline{\;点燃\;}}{\;}$ Na2O2 | B. | HCl+NaOH═NaCl+H2O | ||
| C. | 2CaSO4═2CaO+2SO2↑+O2↑ | D. | Fe2O3+2Al $\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
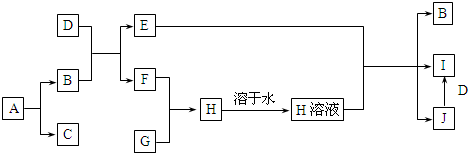 请回答下列问题:
请回答下列问题: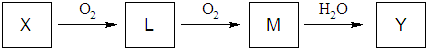
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na在空气中缓慢氧化生成白色的Na2O2 | |
| B. | Na在空气中燃烧生成淡黄色的Na2O2 | |
| C. | Na在空气中燃烧生成淡黄色的Na2O | |
| D. | Na在空气中燃烧生成白色的Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,则该有机物核磁共振氢谱有3 个峰.
,则该有机物核磁共振氢谱有3 个峰.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16 gO2中含有的氧分子数为NA | |
| B. | 1 mol镁原子中含有的电子数为NA | |
| C. | 常温常压下,11.2 L H2中含有的氢分子数为0.5NA | |
| D. | 1L 1 mol/L BaCl2溶液中含有的钡离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
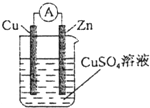
| A. | 铜棒为正极 | B. | 锌棒发生氧化反应 | ||
| C. | 电流从铜棒经外电路流向锌棒 | D. | 锌棒质量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Na+、OH- | B. | H+、Cl-、CH3COO- | C. | Fe2+、H+、NO3- | D. | K+、Ca2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
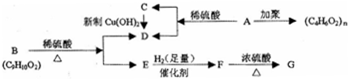
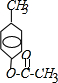 ;
;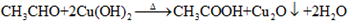 ,反应类型氧化反应;F→G
,反应类型氧化反应;F→G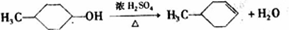 ,反应类型消去反应.
,反应类型消去反应.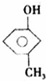 、
、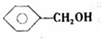 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com