
| A. | 明矾可用于自来水的消毒净化 | |
| B. | Fe2 O3可用作红色油漆和涂料 | |
| C. | 酚醛树脂可用作绝缘、隔热和复合材料 | |
| D. | 硫酸可用于精炼石油以及制取多种挥发性酸 |
分析 A.明矾能水解生成氢氧化铝胶体,用于净水;
B.三氧化二铁颜色为红棕色;
C.酚醛树脂不导电,导热性差;
D.硫酸为沸点高,酸性强,在石油精炼中,要用浓硫酸除去汽油和润滑油中的杂质--硫化物和不饱和碳氢化合物.
解答 解:A.明矾能水解生成氢氧化铝胶体,具有吸附性能够净水,不具有强的氧化性,不能杀菌,故A错误;
B.三氧化二铁颜色为红棕色,可用作红色油漆和涂料,故B正确;
C.酚醛树脂不导电,导热性差,可用作绝缘、隔热和复合材料,故C正确;
D.硫酸为沸点高,酸性强,可用于制取多种挥发性酸,在石油精炼中,要用浓硫酸除去汽油和润滑油中的杂质-硫化物和不饱和碳氢化合物,故D正确;
故选:A.
点评 本题考查了物质的用途,明确物质的性质是解题关键,题目难度不大,注意相关知识的积累.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
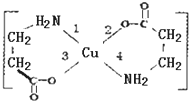 II.二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图:
II.二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知V、W、X、Y、Z是原子序数一次增大的短周期主族元素,V、Y在周期表中的相对位置如表所示,V元素与氧元素能形成两种无色气体,X是地壳中含量罪所的金属元素,请回答下列问题:
已知V、W、X、Y、Z是原子序数一次增大的短周期主族元素,V、Y在周期表中的相对位置如表所示,V元素与氧元素能形成两种无色气体,X是地壳中含量罪所的金属元素,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
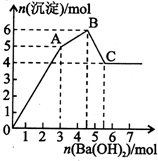 向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是( )
向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是( )| 氢氧化物 | 溶液pH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)3 | 2.3 | 3.4 | ||
| Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
| A. | 据图计算原溶液中c(Cl-)=c(SO42-) | |
| B. | OA段产生的沉淀为BaSO4和Fe(OH)3 | |
| C. | AB段可能发生的反应是:2SO42-+2Ba2++Al3++30H-=2BaSO4k+Al(OH)3↓ | |
| D. | C点溶液呈碱性的原因是AlO2-水解,其离子方程式为:AlO2-+2H2O=Al(OH)3+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在强碱性溶液中:Na+、K+、AlO2-、Cl- | |
| B. | pH=1的溶液中:HCO3-、NH4+、NO3-、Ca2+ | |
| C. | 无色溶液中:Cu2+、NO3-、Cl-、H+ | |
| D. | 无色溶液中:Na+、K+、ClO-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
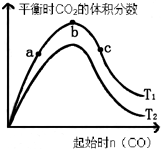 近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:
近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:| t/s | 0 | 10 | 20 | 30 | 50 |
| c(CO)mol/L | 3 | 1.8 | 1.2 | 0.9 | 0.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com