


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 3 |
| 2 |
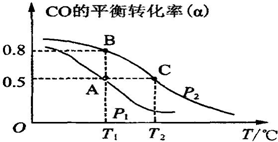
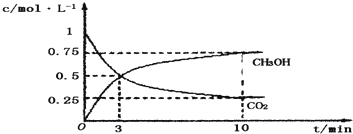
| 16 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| X | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无现象 |
| 稀硝酸 | 沉淀不消失 | 沉淀消失 有气体产生 | 沉淀不消失 | 无现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中c(SO42-)为0.1mol/L、c(CO32-) 为0.2mol/L |
| B、该混合物中不含Ba2+、Mg2+ |
| C、一定存在NH4+、K+,无法确定Cl-是否存在 |
| D、实验(3)沉淀中加盐酸后,若只过滤、不洗涤,会对除NH4+外的其他离子含量的测定造成影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、110g |
| B、110g/mol |
| C、55g/mol |
| D、55 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向盐酸中滴加氨水:H++OH-=H2O |
| B、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C、铜溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2 NO↑+4H2O |
| D、CuSO4溶液与Ba(OH)2溶液混合:Cu2++SO42-+2OH-+Ba2+=BaSO4↓+Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合溶液的pH=7 | ||
B、若混合溶液中c(H+)=
| ||
| C、若混合溶液pH=4,则水电离出的c(H+)=1.0×10-10mol?L-1 | ||
| D、若HA为强酸,则混合后溶液中各离子浓度的大小关系一定为:c(A-)>c(B+)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com