
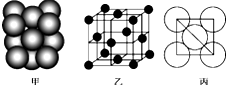
 铜单质晶体中原子的堆积方式如图甲所示,其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示.
铜单质晶体中原子的堆积方式如图甲所示,其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示.分析 ①晶胞中Cu原子位于面心、顶点上,属于面心立方最密堆积;
以顶点Cu原子研究,与之相邻的原子处于面心,每个顶点为8故晶胞共用,每个面心为2个晶胞共有,利用均摊法计算Cu原子配位数;
Ag、Cu等也采取面心立方最密堆积;
设Cu原子半径为d,利用均摊法计算晶胞中Cu原子数目,再计算晶胞中Cu原子总体积,晶胞棱长=4d×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$d,可以计算晶胞体积,晶胞空间利用率=$\frac{原子总体积}{晶胞体积}$×100%;
②利用均摊法计算晶胞中Cu原子数目,可以计算晶胞质量,晶胞棱长=4a cm×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$a cm,晶胞体积为(2$\sqrt{2}$a cm)3,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:①晶胞中Cu原子位于面心、顶点上,属于面心立方最密堆积;
以顶点Cu原子研究,与之相邻的原子处于面心,每个顶点为8故晶胞共用,每个面心为2个晶胞共有,故Cu原子配位数为$\frac{3×8}{2}$=12;
Ag、Cu等也采取面心立方最密堆积;
晶胞中Cu原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,设Cu原子半径为d,则Cu原子总体积为4×$\frac{4}{3}$πd3,晶胞棱长=4d×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$d,晶胞体积为(2$\sqrt{2}$d)3,晶胞空间利用率=$\frac{4×\frac{4}{3}π{d}^{3}}{(2\sqrt{2}d)^{3}}$×100%=74%,
故答案为:面心立方最密堆积;12;Ag、Au;74%;
②晶胞中Cu原子数目为4,晶胞质量为4×$\frac{64}{{N}_{A}}$g,晶胞棱长=4a cm×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$a cm,晶胞体积为(2$\sqrt{2}$a cm)3,则晶胞密度=4×$\frac{64}{{N}_{A}}$g÷(2$\sqrt{2}$a cm)3=$\frac{4×\frac{64}{{N}_{A}}}{(2\sqrt{2}a)^{3}}$g/cm3,
故答案为:$\frac{4×\frac{64}{{N}_{A}}}{(2\sqrt{2}a)^{3}}$g/cm3.
点评 本题考查晶胞计算,注意均摊法的运用,需要学生具有一定的空间想象力与数学计算能力,难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•10H2O),为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验.
小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•10H2O),为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验.| 序号 | a | b | c | d | e |
| 数据 | m1、m2、m3 | m2、m3、m4、m5 | m1、m2、m4 | m1、m4、m5 | m1、m2、m5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
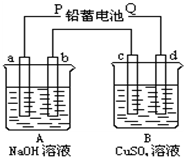 用如图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).
用如图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO42-、CO32-、F- | B. | CO32-、SO42-、F- | C. | CO32-、F-、SO42- | D. | F-、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 | |
| C. | 浓硝酸与木炭反应的离子方程式:C+4H++4NO3-=CO2↑+4NO2↑+2H2O | |
| D. | HNO3→NO→NO2,以上各步变化均能通过一步实现 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com