
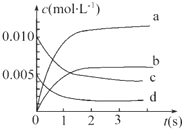
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
分析 (1)第5s时NO为0.007mol,NO转化率=$\frac{NO物质的量变化量}{NO起始物质的量}$×100%;
(2)NO2是产物,随反应进行浓度增大,由方程式可知平衡时△c(NO2)=△c(NO).
根据v=$\frac{△c}{△t}$计算v(NO),再利用速率之比等于化学计量数之比计算v(O2);
(3)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(4)原电池正极发生还原反应,PbO2在正极获得电子,硫酸溶液条件下,生成PbSO4与H2O;
(5)液态肼(N2H4)和双氧水混合反应时,产生大量无污染物质,应生成氮气与水.
解答 解:(1)第5s时NO为0.007mol,NO转化率=$\frac{(0.02-0.007)mol}{0.02mol}$×100%=65%,
故答案为:65%;
(2)NO2是产物,随反应进行浓度增大,由方程式可知平衡时△c(NO2)=△c(NO)=$\frac{(0.02-0.007)mol}{2L}$=0.0065mol/L,所以图中表示NO2变化的曲线是b;
2s内用NO表示的平均反应速率v(NO)=$\frac{\frac{(0.02-0.008)mol}{2L}}{2s}$=3.0×10-3mol•L-1•s-1,速率之比等于化学计量数之比,所以v(O2)=$\frac{1}{2}$v(NO)=$\frac{1}{2}$×3.0×10-3mol•L-1•s-1=1.5×10-3mol•L-1•s-1,
故答案为:b;1.5×10-3mol•L-1•s-1;
(3)a.若反应达到平衡,则v(NO2)正=2v(O2)逆,由于未指明正、逆速率,不能判断反应是否达到平衡,故a错误;
b.由于反应前后气体体积不等的反应,恒温恒容下随反应进行容器内压强变化,当容器内压强保持不变,说明反应达到平衡,故b正确;
c.由方程式可知v正(NO)=2v正(O2),而v逆(NO)=2v正(O2),则v正(NO)=逆(NO),反应到达平衡,故c正确;
d.混合气体总质量不变,容器容积不变,容器内混合气体密度始终不变,故d错误,
故选:bc;
(4)原电池正极发生还原反应,PbO2在正极获得电子,硫酸溶液条件下,生成PbSO4与H2O,正极电极反应式为:PbO2+4H++SO42-+2e-═PbSO4+2H2O,
故答案为:PbO2+4H++SO42-+2e-═PbSO4+2H2O;
(5)液态肼(N2H4)和双氧水混合反应时,产生大量无污染物质,应生成氮气与水,反应方程式为:N2H4+2H2O2=N2+4H2O,
故答案为:N2H4+2H2O2=N2+4H2O.
点评 本题考查化学平衡计算、平衡状态判断、原电池等,为高考常见题型,侧重于学生的分析、计算能力的考查,注意判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,同体积的气体A和气体B的质量比m:n | |
| B. | 25℃,101KPa时,1Kg气体A与1Kg气体B的分子数比为n:m | |
| C. | 同温同压下,气体A与气体B密度比为n:m | |
| D. | 标准状况下,等质量的A与B的体积比为n:m |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在有AgCl沉淀的溶液中加入NaC1固体,c(Ag+)减小 | |
| B. | 室温下100mL pH=1.3的Ba(OH)2溶液中OH-的物质的量为0.02 mol | |
| C. | 稀释0.1 mol/L的NH3•H2O溶液,溶液中所有离子浓度均减小 | |
| D. | 溶液中水电离出c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:| 滴定次数 | 草酸溶液体积 | 酸性KMnO4溶液体积 | |
| 滴定前读数/m L | 滴定后读数/m L | ||
| 第一次 | 25.00 | 0.20 | 20.58 |
| 第二次 | 25.00 | 4.00 | 24.40 |
| 第三次 | 25.00 | 2.38 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 对叔丁基苯酚(
对叔丁基苯酚(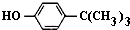 )工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:
)工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化碳的捕捉和利用是能源领域的一个重要战略方向.
二氧化碳的捕捉和利用是能源领域的一个重要战略方向.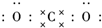 ,所含化学键的类型是共价键.
,所含化学键的类型是共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 起始物质的量浓度(mol/L) | 1.5 | 1 | 0 |
| 2s末物质的量浓度(mol/L) | 0.9 | 0.8 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com