
| A. | H2Se的沸点高于H2S,可推测PH3的沸点高于NH3 | |
| B. | 17g羟基(-OH)所含有的电子数是9NA | |
| C. | σ键是镜面对称,而π键是轴对称 | |
| D. | 标准状况下,11.2 L三氯甲烷所含分子数为0.5 NA |
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ①②③⑥ | C. | ②③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
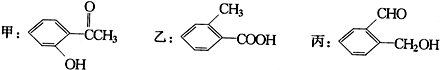
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{56b}{a}$ | B. | $\frac{b}{168a}$ | C. | $\frac{3b}{168a}$ | D. | $\frac{b}{56a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫 | |
| B. | 工业合成氨时选择铁做催化剂能极大加快反应速率 | |
| C. | 向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 | |
| D. | 工业生产硫酸的过程中使用过量的空气以提高SO2的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应都是氧化还原反应 | |
| B. | 复分解反应都不是氧化还原反应 | |
| C. | 在反应 2H2S+SO2=3S+2H2O中,还原剂是SO2 | |
| D. | 在一个氧化还原反应中,同一种反应物不可能既是氧化剂又是还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com