
����Ŀ���������һ�����ϣ����кܺõı������ã�ͨ����Ϊ����ԭ�ϣ���ʹ�����ϵ������������㣮ʵ�����Ʊ������Ļ�ѧ����ʽΪ��
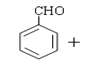 (CH3CO)2
(CH3CO)2 CH3COOH
CH3COOH
��Ҫ�Լ�������������
���� | ������ | ��״ | �ܶ� | �۵� | �е� | �ܽ�ȣ��� | ||
ˮ | �� | �� | ||||||
����ȩ | 106 | ��ɫҺ�� |
|
|
|
| ���� | ���� |
������ | 102 | ��ɫҺ�� |
|
|
| 12 | �� | ���� |
����� | 148 | ��ɫ�ᾧ |
|
| 300 |
| 24 | �� |
�ܶȣ���ѹ��![]() �ⶨ��Ҫʵ�鲽���װ�����£�
�ⶨ��Ҫʵ�鲽���װ�����£�
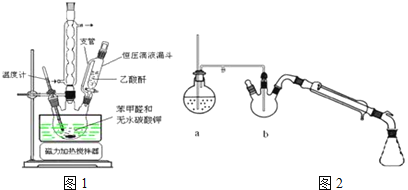
��![]() �ϳɣ���ͼ1��������������
�ϳɣ���ͼ1��������������![]() ����ȩ��
����ȩ��![]() ��������
��������![]() ��ˮ̼��أ���
��ˮ̼��أ���![]() �����˻�������45min��
�����˻�������45min��
��![]() �������ᴿ��
�������ᴿ��![]() �������ϳɵIJ�Ʒ��ȴ��߽������40mlˮ����5���ӣ�����ˮ�������ӻ�����г�ȥδ��Ӧ�ı���ȩ���õ��ֲ�Ʒ��
�������ϳɵIJ�Ʒ��ȴ��߽������40mlˮ����5���ӣ�����ˮ�������ӻ�����г�ȥδ��Ӧ�ı���ȩ���õ��ֲ�Ʒ��![]() �������ֲ�Ʒ��ȴ�����40ml
�������ֲ�Ʒ��ȴ�����40ml![]() ����������ˮ��Һ���ټ�90mlˮ�����Ȼ���̿��ɫ�����ȹ��ˡ���ȴ��
����������ˮ��Һ���ټ�90mlˮ�����Ȼ���̿��ɫ�����ȹ��ˡ���ȴ��![]() ��1��1�������ڽ����¼��뵽���������Һ�У�����Һ�����ԣ�����ȴ����ѹ���ˡ�ϴ�ӡ�����Ȳ����õ��ϴ���������
��1��1�������ڽ����¼��뵽���������Һ�У�����Һ�����ԣ�����ȴ����ѹ���ˡ�ϴ�ӡ�����Ȳ����õ��ϴ���������
ˮ��������ʹ�л�����ڽϵ͵��¶��´ӻ������������������Ա����ڳ�ѹ������ʱ����ɵ���ʧ����߷����ᴿ��Ч�ʣ�ͬʱ�ڲ�����װ�÷���Ҳ�ϼ�ѹ������һЩ������ˮ�����������Ӧ���ڷ�����ᴿ�л���ش��������⣺
(1)�ϳ�������ʵ��������ˮ�����½��У�ʵ��ǰ������������ԭ���� ______ ![]() ʵ����Ϊ�����¶���
ʵ����Ϊ�����¶���![]() ���� ______ �м��ȣ�
���� ______ �м��ȣ�
A.ˮ![]() ����
����![]() �е�
�е�![]()
![]() ɰ��
ɰ��![]() ֲ����
ֲ����![]() �е�
�е�![]()
(2)ͼ2��װ��a�������� ______ ��װ��b�г���������Ҫ���������е�ԭ���� ______ ��ˮ����������Ʒ�� ______ ![]() ����������
����������![]() ��
��
(3)���ȹ��˵�Ŀ�� ______ ��
(4)����1��1�������Ŀ���� ______ ����������ᾧ����˺�ϴ�ӣ�ϴ�Ӽ��� ______ ��
(5)5.3g����ȩ��![]() ��������
��������![]() ��ˮ̼��س�ַ�Ӧ�õ������ʵ��
��ˮ̼��س�ַ�Ӧ�õ������ʵ��![]() ��������� ______
��������� ______ ![]() ����3λ��Ч����
����3λ��Ч����![]() ��
��
���𰸡���������ˮ�� BD ����ˮ���� ʹ�������ˮ������ֽӴ����������ᴿ����� ������ƿ ��ֹ������ƽᾧ����������©�� ʹ�������ת��Ϊ����� ˮ ![]()
��������
![]() ��������ˮ�⣬������������������ʵ����Ϊ�����¶���
��������ˮ�⣬������������������ʵ����Ϊ�����¶���![]() ��ѡ��ķе�����жϣ�
��ѡ��ķе�����жϣ�
![]() ����ˮ�����������Ӧ���ڷ�����ᴿ�л������ͼ2��ˮ����������Ʒ��������ƿ�У�װ��b�г���������Ҫ���������У�ʹ�������ˮ������ֽӴ����������ᴿ����
����ˮ�����������Ӧ���ڷ�����ᴿ�л������ͼ2��ˮ����������Ʒ��������ƿ�У�װ��b�г���������Ҫ���������У�ʹ�������ˮ������ֽӴ����������ᴿ����
![]() �¶ȵ�������Ƶ��ܽ�Ƚ��ͣ���ᾧ�������壬���Գ��ȹ��˵�Ŀ���Ƿ�ֹ������ƽᾧ����������©����
�¶ȵ�������Ƶ��ܽ�Ƚ��ͣ���ᾧ�������壬���Գ��ȹ��˵�Ŀ���Ƿ�ֹ������ƽᾧ����������©����
![]() ����������ǿ�ᣬ���Լ���1��1�������Ŀ����ʹ�������ת��Ϊ��������ᾧ����ˮ�е��ܽ�Ⱥ�С���ݴ˴��⣻
����������ǿ�ᣬ���Լ���1��1�������Ŀ����ʹ�������ת��Ϊ��������ᾧ����ˮ�е��ܽ�Ⱥ�С���ݴ˴��⣻
![]() �ȸ��ݱ����ܶȼ��������ȩ�����������������ټ�������ǵ����ʵ�����Ȼ������������������������������������IJ��ʡ�
�ȸ��ݱ����ܶȼ��������ȩ�����������������ټ�������ǵ����ʵ�����Ȼ������������������������������������IJ��ʡ�
![]() ��������ˮ�⣬�������������� ����ˮ�ķе�ֻ��
��������ˮ�⣬�������������� ����ˮ�ķе�ֻ��![]() ������ͨ��ˮԡ���ȣ���A���� ���ڸ��Ͷ��ķе����
������ͨ��ˮԡ���ȣ���A���� ���ڸ��Ͷ��ķе����![]() ����B��ȷ�� ɳ���ǹ��壬�����ڿ����¶ȣ�C���� ����ֲ���͵ķе����
����B��ȷ�� ɳ���ǹ��壬�����ڿ����¶ȣ�C���� ����ֲ���͵ķе����![]() ������ʵ����Ϊ�����¶���
������ʵ����Ϊ�����¶���![]() ����ֲ�����м��ȣ���ѡBD��
����ֲ�����м��ȣ���ѡBD��
�ʴ�Ϊ����������ˮ�⣻BD��
![]() ˮ�����������Ӧ���ڷ�����ᴿ�л������ͼ2��ˮ����������Ʒ��������ƿ�У�װ��b�г���������Ҫ���������У�ʹ�������ˮ������ֽӴ����������ᴿ����
ˮ�����������Ӧ���ڷ�����ᴿ�л������ͼ2��ˮ����������Ʒ��������ƿ�У�װ��b�г���������Ҫ���������У�ʹ�������ˮ������ֽӴ����������ᴿ����
�ʴ�Ϊ������ˮ������ʹ�������ˮ������ֽӴ����������ᴿ����������ƿ��
![]() �¶ȵͣ�������Ƶ��ܽ�Ƚ��ͣ���ᾧ�������壬���Գ��ȹ��˵�Ŀ���Ƿ�ֹ������ƽᾧ����������©����
�¶ȵͣ�������Ƶ��ܽ�Ƚ��ͣ���ᾧ�������壬���Գ��ȹ��˵�Ŀ���Ƿ�ֹ������ƽᾧ����������©����
�ʴ�Ϊ����ֹ������ƽᾧ����������©����
![]() ������ǿ�ᣬ���Լ���1��1�������Ŀ����ʹ�������ת��Ϊ��������ᾧ����ˮ�е��ܽ�Ⱥ�С�����Կ�����ˮϴ�ӣ�
������ǿ�ᣬ���Լ���1��1�������Ŀ����ʹ�������ת��Ϊ��������ᾧ����ˮ�е��ܽ�Ⱥ�С�����Կ�����ˮϴ�ӣ�
�ʴ�Ϊ��ʹ�������ת��Ϊ����ˮ��
![]() ����ȩ��
����ȩ��![]() �����������ߵ����ʵ����ֱ���
�����������ߵ����ʵ����ֱ���![]() ��
��![]() �����Ը��ݷ���ʽ��֪��������������������������������������
�����Ը��ݷ���ʽ��֪��������������������������������������![]() �����Բ����ǣ�
�����Բ����ǣ�![]() ��
��
�ʴ�Ϊ��![]() ��
��


 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧΪ��̽������CO2�ķ�Ӧ��������ͼװ�ý���ʵ�顣����֪PdCl2�ܱ�CO��ԭΪ��ɫ��Pd��
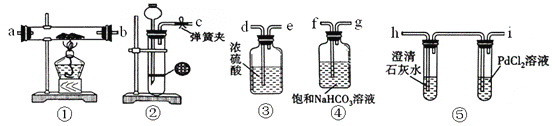
��1��װ�â�����ϡ������CaCO3��Ӧ�Ʊ�CO2���ڼ�ϡ����ʱ������CaCO3��ϡ����ܽӴ�����ϡ�����ֲ����ˣ�Ϊʹ��Ӧ��˳�����У�����©���м�����Լ���_______��
A. H2SO4��Һ B. CCl4 C. �� D. ϡ����
��2���뽫ͼ�и�װ�ð�˳�����ӣ���װ�ýӿ���ĸ����c��______��______��____��____��______��____��____��
��3��װ�âܵ�������__________��
��4�������װ�������Բ�װ��ҩƷ��ȼ�ƾ���֮ǰӦ���еIJ����Ǵ��ɼУ���CO2��������װ�ã����۲쵽_________ʱ�ٵ�ȼ�ƾ��ơ�
��5������Ӧ������CO2����������CO2��ַ�Ӧ�����ɵĹ������ʿ����ж����������ͬѧ������²��룺
�����ɵĹ�������ΪNa2CO3
�����ɵĹ�������ΪNs2CO3��C�Ļ����
�����ɵĹ�������ΪNs2CO3��Na2O�Ļ����
�����ɵĹ�������ΪNs2O��C�Ļ����
���練Ӧ���������������������
I. �۲쵽װ�â�PdCl2��Һ���к�ɫ��������װ�â��й���ɷ�ֻ��һ�֣���������м���ϡ����ɲ�����ʹ����ʯ��ˮ����ǵ����壬д�������������CO2��Ӧ�Ļ�ѧ����ʽ____��
II. װ�â����Ƶ�����Ϊ0.46g����ַ�Ӧ��װ�â��еĹ������������ϡ�����в���224ml����״����CO2���壬��Һ�в������������Ϊ___________��
��6�����ʵ�鷽��֤��װ�â��м���Ľ����Ʋ��ֱ�����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У������������ᣨ�ף� Ka=1.8��10-5����һ�����ᣨ�ң� Ka=1.4��10-3����ˮ�еĵ������Ũ�ȹ�ϵ���ǣ���
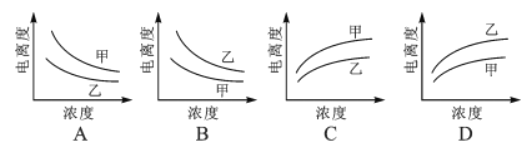
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̫���ܹ����ص��ˮ�ɽ����Ƶøߴ�H2��O2������ʾ��ͼ��ͼ��ʾ������˵��������ǣ� ��

A.��H2ʱ������K1����O2ʱ������K2
B.����H2�ĵ缫��Ӧʽ��2H++2e-=H2��
C.��O2ʱ�缫3�����ĵ缫��ӦΪNiOOH+H2O+e-=Ni��OH��2+OH-
D.ͨ�����ƿ��ؽ�������K1��K2������ʹ�缫3ѭ��ʹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������25��ʱijЩ����ĵ���ƽ�ⳣ��������˵����ȷ���ǣ� ��
��ѧʽ | CH3COOH | HClO | H2CO3 |
Ka | 1.8��10��5 | 3.0��10��8 | Ka1=4.1��10��7 Ka2=5.6��10��11 |
A. ��ͬŨ��CH3COONa��NaClO�Ļ��Һ�У�������Ũ�ȵĴ�С��ϵ�ǣ�c��Na+����c��ClO������c��CH3COO������c��OH������c��H+��
B. ��0.1mol��L��1CH3COOH��Һ�еμ�NaOH��Һ����ҺpH=5����ʱ��Һ��c��CH3COOH����c��CH3COO����=9��5
C. ����̼�����ƹ�����뵽���Ƶ���ˮ�У�c��HClO������
D. ����������ʵ���Ũ�ȵ�CH3COONa��aq����NaClO��aq��������������С��Nǰ��N��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���Ϊ��������Դ��Խ��Խ�ܵ����ǵĹ�ע����֪�״��Ʊ����йػ�ѧ��Ӧ��ƽ�ⳣ�����ʱ���������
��ѧ��Ӧ | 500��ƽ�ⳣ�� | �ʱ� |
��CO(g)��2H2(g) | K1��2.5 | ��H1����116 kJ��mol��1 |
��CO2(g)��H2(g) | K2��1.0 | ��H2����41 kJ��mol��1 |
��CO2(g)��3H2(g) | K3���� | ��H3���� |
��1����Ӧ�۵�K3��__����H3��___��
��2�����ڷ�Ӧ�������¶�ƽ�ⳣ��___(�������С�����䡱)��
��3��500��ʱ��÷�Ӧ����ijʱ��CO2(g)��H2(g)��CH3OH(g)��H2O(g)��Ũ��(mol��L��1)�ֱ�Ϊ0.1��0.8��0.3��0.15�����ʱv��__v��(����>����<������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Bi��OH��3+3OH-+Cl2+Na+=NaBiO3+2C1-+3H2O����5NaBiO3+2Mn2++14H+=2MnO4-+5Bi3++5Na++7H2O�������ƶϲ���ȷ���ǣ� ��
A.��Ӧ���У�����10.45gBi3+����ʱת�Ƶ�����Ϊ0.5NA
B.�κ������£������������ԣ�C12��NaBiO3��MnO4-
C.NaBiO3�������ᷢ����Ӧ��NaBiO3+6H++2C1-=Bi3++Na++C12��+3H2O
D.��֪BiC13����Bi2O3����ˮ��Ũ�����Ũ����Ļ�����Ӧ��ȡ��˵��Bi3+���ܱ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��������ʵ��ܶȻ��������±���
���� | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp |
|
|
|
|
��1��ij����CuCl2��Һ�к�������FeCl3��Ϊ�Ƶô���CuCl2��Һ�����ȼ���_______�����Լ�����ʽ����Ȼ�������ҺpH��4��ʹFe3��ת��ΪFe(OH)3��������ʱ��Һ�е�c(Fe3��)��________________��
��2������CuCl��CuI���干�������Һ�У�C��Cl-��______C��I-������ > < =��
ij��Һ��C��Cl-��Ϊ0.0001 mol��L��1, C��I-��Ϊ0.1 mol��L��1������Һ�еμ�������ͭ���Ȳ����ij�����__________���������ѧʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷���FeSO4��7H2O��������ԭ������ɫ������ҩ�ȣ��ڲ�ͬ�¶����ֽ�õ��������������������������֪SO3��һ����ɫ���壬�۵�16.8�棬�е�44.8�棬�����Լ���ˮ�Խ�Ũ����ǿ����Ư��ijЩ�л�Ⱦ�ϣ���Ʒ��ȡ��ش��������⣺
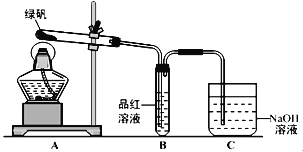
��1������ͬѧ������ͼ��ʾ��װ�ã�ͨ��ʵ������̷��ķֽ���װ��B�пɹ۲쵽��������_____________________________�������ɴ˵ó��̷��ķֽ�����к���SO2��װ��C��������_________________________��
��2������ͬѧ��Ϊ����ͬѧ��ʵ����۲��Ͻ�����Ϊ��Ҫ����ʵ�顣�Լ���ͬѧ����ʵ���Bװ�õ��Թܼ��ȣ�������ɫ��Ʒ����Һδ�ָ���ɫ�����֤���̷��ֽ�IJ�����__________������ĸ����
A������SO2 B�����ܺ�SO2 C��һ������SO3
��3������ͬѧ�������Ϸ����̷����ȷֽ������O2�ų���Ϊ�ˣ�����ͬѧѡ�ü���ͬѧ�IJ���װ�ú���ͼ����װ����Ƴ���һ�����̷��ֽ�������̬�����װ�ã�
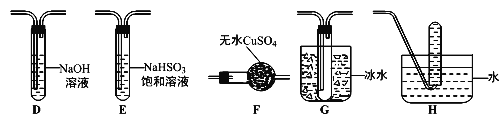
�ٱ���ͬѧ��ʵ��װ���У��������ӵĺ���˳��Ϊ_______________________��
����֤���̷��ֽ��������O2�ļ��鷽����________________________��
��4��Ϊ֤���̷��ֽ�����к����������IJ���������____________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com