
| A. | 将碳、氢元素符号省略,只表示分子中键的连接情况 | |
| B. | 每个拐点、交点、端点均表示有一个碳原子 | |
| C. | 每一条线段代表一个共价键,每个碳原子有四条线段,用四减去线段数即是氢原子数 | |
| D. | C=C、C≡C键等官能团中的“=”和“≡”也可以省略 |
分析 若将有机物分子中碳、氢元素符号省略,而只表示分子中键的连接情况,每个拐点或终点均表示一个碳原子,称为键线式;官能团碳碳双键、碳碳三键不能省略,据此对各选项进行判断.
解答 解:将有机物分子中碳、氢元素符号省略,而只表示分子中键的连接情况,每个拐点或终点均表示一个碳原子,称为键线式,
A.根据键线式的概念可知,键线式是将碳、氢元素符号省略,只表示分子中键的连接情况,故A正确;
B.键线式中的每个拐点、交点、端点均表示有一个碳原子,故B正确;
C.键线式中的每一条线段代表一个共价键,每个C最多形成4个共价键,用四减去线段数即是一个碳原子上连接的氢原子个数,故C正确;
D.键线式中,官能团不能省略,所以C=C、C≡C键等官能团中的“=”和“≡”不能省略,故D错误;
故选D.
点评 本题考查了有机物的键线式的概念及表示方法判断,题目难度中等,明确键线式的概念及表示方法为解答关键,注意键线式中官能团不能省略,为易错点.


科目:高中化学 来源: 题型:填空题
| 实验装置 | 现象 |
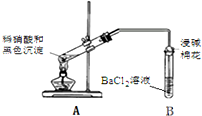 | 1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机反应中常用镍作催化剂.某镍催化剂中含Ni 64.0%、Al 24.3%、Fe 1.4%,其余为C、H、O、N等元素.
有机反应中常用镍作催化剂.某镍催化剂中含Ni 64.0%、Al 24.3%、Fe 1.4%,其余为C、H、O、N等元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L Na2CO3溶液中的Na+数目为2NA | |
| B. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子 | |
| C. | 标准状况下,11.2LSO3所含分子数为0.5NA | |
| D. | 各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.48L | B. | 5.6L | C. | 6.72L | D. | 13.44L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷的分子式是C3H6 | |
| B. | 丙烷分子中的碳原子在一条直线上 | |
| C. | 丙烷在光照条件下能够和氯气发生加成反应 | |
| D. | 丙烷的熔点比乙烷高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干水属于有机合成材料 | |
| B. | 干水中的水分子停止运动 | |
| C. | 干水是一种混合物 | |
| D. | 干水吸收CO2的过程只发生物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com