
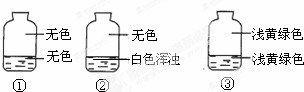
 向盛有氯气的三个集气瓶中,分别注入约五分之一的下列液体并振荡,观察如图所记录的现象,判断各瓶注入的液体依次是什么.( )
向盛有氯气的三个集气瓶中,分别注入约五分之一的下列液体并振荡,观察如图所记录的现象,判断各瓶注入的液体依次是什么.( )| A. | AgNO3溶液、NaOH溶液、水 | B. | NaOH溶液、AgNO3溶液、水 | ||
| C. | 水、AgNO3溶液、NaOH溶液 | D. | AgNO3溶液、水、NaOH溶液 |
分析 氯气为黄绿色气体,能溶于水,溶于水得到氯水,氯水因为溶解氯气显浅黄绿色;氯气能够与氢氧化钠反应生成氯化钠和次氯酸钠和水;氯气与水反应生成盐酸和次氯酸,盐酸与硝酸银反应生成氯化银白色沉淀,据此解答.
解答 解:氯气为黄绿色气体,能溶于水,溶于水得到氯水,氯水因为溶解氯气显浅黄绿色,三个集气瓶中只有③颜色为浅黄绿色,所以③中液体为水;
氯气与水反应生成盐酸和次氯酸,盐酸与硝酸银反应生成氯化银白色沉淀,①和②中,只有②出现了白色的沉淀,所以②中液体为硝酸银溶液;
氯气能够与氢氧化钠反应生成氯化钠和次氯酸钠和水,所以氯气被氢氧化钠吸收,溶液为无色,故①中液体为氢氧化钠溶液;
故选B.
点评 本题考查了氯水的性质,明确氯水的成分是解题关键,题目难度不大.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:④最大 | |
| B. | ①中水的电离程度最小,③中水的电离程度最大 | |
| C. | 将四份溶液稀释相同倍数后,溶液的pH:④>③,①>② | |
| D. | 将②、③混合,若pH=7,则消耗溶液的体积:②<③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cl-、NO3- | B. | Ca2+、Cl-、CO32- | C. | K+、H+、HCO3- | D. | Cu2+、H+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 加入试剂 | 被检出物质 | 理由 |
| 水 | CuSO4 | CuSO4溶于水溶液显蓝色 |
| 加入试剂 | 被检出物质 | 离子方程式 |
| CuSO4 |
| 加入试剂 | 被检出物质 | 离子方程式 |
| MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
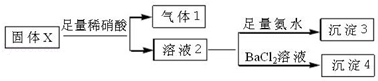
| A. | 气体1可能为SO2和CO2的混合物 | |
| B. | 沉淀3可能为Mg(OH)2和Al(OH)3的混合物 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有Na2CO3和KAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com