
| Q | I1 | I2 | I3 | I4 | I5 | … |
| 电离能(kJ/mol) | 496 | 4562 | 6912 | 9543 | 13353 | … |
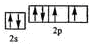 ,故答案为:
,故答案为: ;
;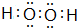 ,化合物HCN中C原子和N原子共用3对电子、H原子和C原子共用1对电子,所以HCN的结构式H-C≡N,
,化合物HCN中C原子和N原子共用3对电子、H原子和C原子共用1对电子,所以HCN的结构式H-C≡N,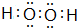 ;H-C≡N;
;H-C≡N;| 1 |
| 2 |
| 1 |
| 2 |


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
| A、将氨水逐滴滴入AgNO3溶液中,至过量 |
| B、将二氧化碳通入Ca(OH)2 溶液中,至过量 |
| C、将氯气通入AgNO3溶液中好,至过量 |
| D、将二氧化氮通入Ba(OH)2 溶液中,至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
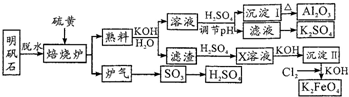
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
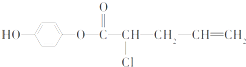 ,下列叙述中,正确的是( )
,下列叙述中,正确的是( )| A、该有机物的分子式为C11H13O3Cl |
| B、1mol该有机物最多可消耗2molNaOH |
| C、该有机物既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色 |
| D、该有机物中所有原子一定在同一平面内 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Ca2+、Na+、CO32- |
| B、Mg2+、Al3+、SO42-、Cl- |
| C、Cu2+、Mg2+、Cl-、OH- |
| D、K+、Na+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
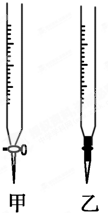 某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,完成以下填空:
某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,完成以下填空:| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 20 | 1.02 | 21.02 |
| 2 | 20 | 2.00 | 25.00 |
| 3 | 20 | 0.60 | 20.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| B、向稀Fe(NO3)2和NaBr混合溶液中滴加稀盐酸6Br-+8H++2NO3-=3Br2+2NO↑+4H2O |
| C、Na2S溶液中滴加NaClO溶液:S2-+ClO-+H2O=S↓+Cl-+2OH- |
| D、双氧水使酸性KMnO4溶液褪色2MnO4-+5H2O2=2Mn2++5O2↑+6OH-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸发操作可以从溶液中分离得到可溶性固体溶质 |
| B、将待过滤的液体直接倒入漏斗中,且使液面低于滤纸边缘 |
| C、可以使用分液的方法分离植物油和水的混合物,植物油从分液漏斗上口倒出 |
| D、蒸馏操作时,温度计的水银球不能伸入液面以下,应在蒸馏烧瓶的支管口处 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胃舒平[主要成分是Al(OH)3] |
| B、苏打(主要成分是Na2CO3) |
| C、小苏打(主要成分是NaHCO3) |
| D、碳酸钡粉末 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com