
| A. | 原子半径B>A>C>D | B. | 原子序数 a>b>c>d | ||
| C. | 离子半径C3->D->B+>A2+ | D. | 离子的还原性C3->D- |
分析 已知短周期元素的离子,aA2+、bB+、cC3-、dD- 都具有相同的电子层结构,则离子核外电子数相同,即a-2=b-1=c+3=d-1,原子序数A>B>D>C,A、B处于同一周期,C、D处于同一周期,且A、B处于C、D所在周期的相邻下一周期,A、B形成阳离子,则A、B为金属,C、D形成阴离子,则C、D为非金属.结合元素周期律进行解答.
解答 解:已知短周期元素的离子,aA2+、bB+、cC3-、dD- 都具有相同的电子层结构,则离子核外电子数相同,即a-2=b-1=c+3=d-1,原子序数A>B>D>C,A、B处于同一周期,C、D处于同一周期,且A、B处于C、D所在周期的相邻下一周期,A、B形成阳离子,则A、B为金属,C、D形成阴离子,则C、D为非金属.
A.aA2+、bB+、cC3-、dD- 都具有相同的电子层结构,则离子核外电子数相同,即a-2=b-1=c+3=d-1,原子序数A>B>D>C,A、B处于同一周期,C、D处于同一周期,且A、B处于C、D所在周期的相邻下一周期,同周期,原子序数越大原子半径越小,所以原子半径B>A,C>D,电子层越大原子半径越大,所以原子半径B>A>C>D,故A正确;
B.aA2+、bB+、cC3-、dD- 都具有相同的电子层结构,则离子核外电子数相同,即a-2=b-1=c+3=d-1,原子序数a>b>c>d,故B错误;
C.电子层结构相同,核电荷数越大,离子半径越小,核电荷数A>B>D>C,所以离子半径C3->D->B+>A2+,故C正确;
D.C、D处于同一周期,C、D形成阴离子,则C、D为非金属,原子序数D>C,则离子的还原性C3->D-,故D正确.
故选B.
点评 本题考查位置结构性质的相互关系及应用,本题根据核外电子排布确定元素所在周期表中的位置以及把握元素周期律的递变规律是解答该题的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

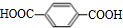 +n HOCH2CH2CH2OH$→_{△}^{浓硫酸}$
+n HOCH2CH2CH2OH$→_{△}^{浓硫酸}$ +(2n-1)H2O,该反应的反应类型为缩聚反应.
+(2n-1)H2O,该反应的反应类型为缩聚反应.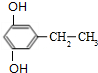 (填结构简式,任写一种)
(填结构简式,任写一种)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷(C3H8)和乙醇(C2H5OH)均存在同分异构体 | |
| B. | 乙烯和苯使溴水褪色的原理相同 | |
| C. | 乙醇和乙酸均可与钠反应放出氢气 | |
| D. | 糖类、油脂、蛋白质均为高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4℃时,18g 21H2168O中含有电子数为10NA | |
| B. | 在密闭容器中加入1.5 mol H2和0.5 molN2,充分反应后可得到NH3分子数为NA | |
| C. | 常温下,1L0.1mol•L-1的NH4NO3溶液中所含氮原子数为0.2 NA | |
| D. | 标准状况下,22.4 L的CCl4中C-Cl键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
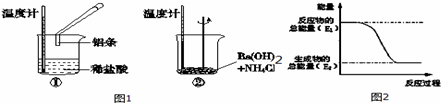
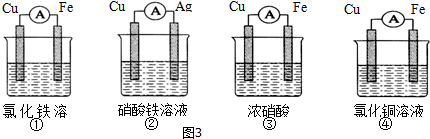

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比为1:6 | |
| B. | HCl发生还原反应 | |
| C. | 氧化性KClO3>Cl2 | |
| D. | 被还原的物质是HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 离子半径Z<Y<M | |
| B. | X的氧化物能与水反应生成相应的酸 | |
| C. | 气态氢化物的稳定性:Z>Y>X | |
| D. | Y的最高价氧化物对应的水化物属于共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 试剂(或条件) | ||
| A | 用温度的变化鉴别二氧化氮和溴蒸气 | ①热水浴 | ②冷水浴 |
| B | 用Na块检验乙醇分子中存在不同于烃分子里的氢原子 | ①乙醇 | ②己烷 |
| C | 用不同的有色物质比较二氧化硫和氯水漂白性的差异 | ①石蕊 | ②品红 |
| D | 用溴水检验苯的同系物中烷基对苯环有影响 | ①苯 | ②甲苯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com