
| 6.4g |
| 64g/mol |


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
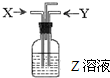 (2011?崇明县一模)如图,下列各组中,一定量的气体X和一定量的气体Y同时通入盛有溶液Z的洗气瓶中,最终肯定有沉淀生成的是(假定实验过程中不发生倒吸现象)…( )
(2011?崇明县一模)如图,下列各组中,一定量的气体X和一定量的气体Y同时通入盛有溶液Z的洗气瓶中,最终肯定有沉淀生成的是(假定实验过程中不发生倒吸现象)…( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com