
 Ⅰ.一定条件下,O2可通过得失电子转化为O2-、O2+ 和O22-.
Ⅰ.一定条件下,O2可通过得失电子转化为O2-、O2+ 和O22-. .
.分析 (1)氧化性指得到电子的能力,O2+为缺电子,O2-和O22-为得电子形成的微粒;
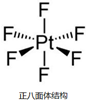
(2)O2PtF6是氧所形成的正价盐,属于离子化合物,O2(PtF6)中含有O2+和PtF6-离子;O2+中O原子之间通过2个共用电子对结合;
(3)根据价层电子对=σ 键电子对+中心原子上的孤电子对,杂化类型为sp3杂化,价层电子对是4;
(4)O2[PtF6]晶体为离子化合物,根据离子化合物的性质分析;
(5)O2、Xe的第一电离能分别为1175.7kJ•mol-1和1175.5kJ•mol-1,两者第一电离能几乎相等;
(6)Xe[PtF6]为Xe+和[PtF6]-构成的离子晶体,O2[PtF6]为O2+和PtF6-构成的离子晶体,根据晶格能(U)计算公式分析.
解答 解:(1)氧化性指得到电子的能力,越缺电子,越易得到电子,O2+为缺电子,得电子能力最强,氧化性最强,O2-和O22-为得电子形成的微粒,氧化性弱,O2+、O2、O2-、O22-四种微粒所含的电子数逐渐增多,所以四种含氧微粒氧化性由强到弱的顺序为:O2+>O2>O2->O22-,
故答案安为:O2+>O2>O2->O22-;O2+缺电子,且四种微粒所含的电子数逐渐增多;
(2)O2(PtF6)中含有O2+和PtF6-离子,O2+中O原子之间通过2个共用电子对结合,则O2+的电子式为: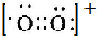 ,
,
故答案安为: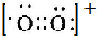 ;
;
(3)PtF6分子中Pt的σ 键电子对=6,而杂化类型为sp3杂化,价层电子对是4,所以PtF6分子中Pt的杂化轨道类型不是sp3,
故答案安为:否;sp3杂化应呈正四面体结构(或配位数最多只能为4);
(4)离子化合物具有较高熔点,较大硬度,O2[PtF6]为离子型配位化合物,所以O2[PtF6]晶体具有的物理性质有较高熔沸点;较高硬度,
故答案安为:较高熔沸点;较高硬度;
(5)O2[PtF6]中含有O2+和PtF6-离子,O2+、PtF6-能形成离子键,O2、Xe的第一电离能分别为1175.7kJ•mol-1和1175.5kJ•mol-1,两者第一电离能几乎相等,失去1个电子能力相当,所以Xe也能与PtF6反应,
故答案安为:两者第一电离能几乎相等,失去1个电子能力相当;
(6)Xe[PtF6]为Xe+和[PtF6]-构成的离子晶体,O2[PtF6]为O2+和PtF6-构成的离子晶体,两者正负离子电荷数的绝对值相等,Xe[PtF6]、O2[PtF6]的晶格能U1与U2关系为U2=U1+41.84,且 n1=12,n2=9,U2>U1,所以阳离子半径Xe+>O2+,
故答案安为:Xe+>O2+.
点评 本题综合考查物质结构元素周期律有关知识,为高考常见题型,侧重于学生的分析能力的考查,注意把握物质的性质与结构的关系,题目难度中等.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 28g乙烯所含共用电子对数目为4NA | |
| B. | 1mol C4H10分子中共价键总数为13NA | |
| C. | 1 mol甲基所含的电子总数为7NA | |
| D. | 标准状况下,11.2 L己烷所含分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,1 L pH=12的氨水溶液中含有0.01NA个NH4+ | |
| B. | 1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒 | |
| C. | 常温常压下,11.2L O2和O3的混合气体含有0.5NA个分子 | |
| D. | 78g Na2O2固体中含有离子总数必为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 置换反应 | C. | 分解反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
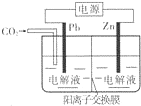 采用电化学法还原CO2是一种使CO2资源化的方法,下图是利用此法制备ZnC2O4的示意图(电解液不参与反应).下列说法正确的是( )
采用电化学法还原CO2是一种使CO2资源化的方法,下图是利用此法制备ZnC2O4的示意图(电解液不参与反应).下列说法正确的是( )| A. | Zn与电源的负极相连 | |
| B. | ZnC2O4在交换膜右侧生成 | |
| C. | 电解的总反应为:2C02+Zn$\frac{\underline{\;电解\;}}{\;}$ZnC2O4 | |
| D. | 通入11.2 L CO2时,转移0.5 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质和油脂都属于高分子化合物,一定条件下都能水解 | |
| B. | 甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 | |
| C. | 乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 | |
| D. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com